Ізоферменти (ізозоми) – це множинні генетично детерміновані форми одного ферменту, які каталізують одну й ту саму хімічну реакцію, але відрізняються за будовою, фізико-хімічними, імунологічними та каталітичними властивостями.
Лише ферменти з четвертинною структурою можуть мати ізоферментні форми, які формуються в результаті комбінацій різних субодиниць.
Наявність та вміст ізоферментів у тканинах залежать від особливостей метаболізму в ній. Тому визначення активності ізоферментів в крові успішно використовується для діагностики захворювань внутрішніх органів.
Класичним прикладом ізоферментів є ізоферменти лактатдегідрогенази (ЛДГ або LDH).
Цей фермент каталізує реакцію зворотного перетворення лактату в піруват:

Піруват Лактат
Молекула ЛДГ містить чотири субодиниці двох видів: М (від англ. muscle – м’яз) та Н (від англ. heart – серце). Комбінація цих ланцюгів дає п’ять ізоферментів:
| Назва ізоферменту | Структура | Переважна локалізація |
| ЛДГ1 | НННН (Н4) | Серце, нирки, еритроцити |
| ЛДГ2 | НННМ (Н3М) | Серце, нирки, еритроцити |
| ЛДГ3 | ННММ (Н2М2) | Легені |
| ЛДГ4 | НМММ (НМ3) | М’язи, печінка |
| ЛДГ5 | ММММ (М4) | М’язи, печінка |
Залежно від типу обміну в різних тканинах спостеріга-ється різна активність ізоферментів ЛДГ. Відомо, що в тканинах з аеробним типом обміну переважає активність ЛДГ1 та ЛДГ2, які зміщують хімічну рівновагу в напрямку перетворення лактату в піруват (наприклад, у серці). При анаеробному типі метаболізму в тканині зростає активність ЛДГ4 та ЛДГ5, які каталізують перетворення пірувату в лактат (наприклад, скелетні м’язи, мозкова частина нирок). Але не завжди можливо зв’язати тип обміну та ізоферментний спектр ЛДГ. Так, наприклад, в еритроцитах, тромбоцитах, кришталику ока основним є анаеробний тип обміну, але найбільш активні - ЛДГ1 і ЛДГ2. Це може бути пов’язано з тим, що субодиниці ЛДГ беруть участь не лише в реакціях на тип обміну.
Для визначення активності ізоферментів ЛДГ використовують метод електрофорезу (ізоферменти мають різну електрофоретичну рухливість). На рис. 19 наведені приклади електрофореграм ізоферментів ЛДГ для різних органів і станів.
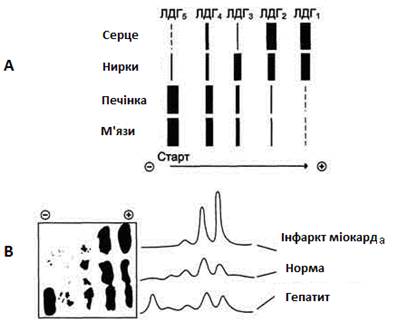
Розподіл ізоферментів ЛДГ на електрофореграмі:
А) для різних органів;
В) у плазмі крові при різних станах.
Характер змін активності ізоферментів ДЛГ при різних захворюваннях
ЛДГ – це поширений фермент, активність якого найбільша в серці, печінці, нирках, м’язах. При руйнації клітин фермент потрапляє в кров, і його активність у сироватці крові може значно зростати, що використовується для діагностики патологічних процесів різної локалізації. У таблиці 7 наведений характер змін ізоферментів ЛДГ при різних захворюваннях.
Характер змін активності ізоферментів ЛДГ у сироватці крові при різних патологіях
| Захворювання | Характер змін ізоферментів ЛДГ у сироватці крові | |
| Інфаркт міокарда | ↑ЛДГ1 в 2 і більше разів; ЛДГ1/ЛДГ2>1 (при нормі 0,45-0,75) | |
| Захворювання печінки | ↑ЛДГ4, ЛДГ5 | |
| Злоякісні захворювання | ↑ЛДГ5 | |
| Захворювання м’язів | ↑ЛДГ5 | |
| Захворювання нирок | ↑ЛДГ3 | |
| Захворювання легень (емболія, тромбоз легеневої артерії) | ↑ЛДГ3 |
Ізоферментні форми існують також для креатинфосфокінази (КФК) (друга назва - креатинкіназа (КК), яка у своєму складі має дві субодиниці різних типів М (від англ., muscle - м’яз) і В (від англ. brain - мозок).
Комбінація цих протомерів дає три ізоферменти:
| Назва ізоформи відповідно до будови | Переважна локалізація | Норма від загальної активності КФК у крові | |
| ММ-КФК | Скелетні м’язи | 97-100 % | |
| МВ-КФК | Міокард | 0-3% | |
| ВВ-КФК | Мозок | 0 % |
Активність ізоферментів КФК визначають також за допомогою електрофорезу. На рис.20 наведена схема, яка ілюструє електрофоретичну рухливість ізоферментів КФК (найбільшу електрофоретичну рухливість має ВВ-КФК).

Електрофоретична рухливість ізоферментів КФК
Визначення ізоферментного спектру КФК має діагностичне значення при патологіях різної локалізації. У таблиці 8 наведений перелік захворювань та станів, при яких спостерігається підвищення активності в сироватці крові кожного із названих ізоферментів КФК.
Підвищення активності ізоферментів КФК в сироватці крові
| Ізофермент | Захворювання та стани | |
| ММ | Травми скелетних м’язів, м’язова дистрофія, дерматоміозит, полі міозит, гіпотиреоз, тяжка фізична праця | |
| МВ | Інфаркт міокарда (через 2-4 години від початку), ушкодження м’язів, синдром Рея | |
| ВВ | Важкий шок, злоякісні захворюван-ня (карцинома яєчників, молочної залози, простати) |
Для діагностики захворювань внутрішніх органів найчастіше визначають активність таких ферментів сироватки крові, як амінотрансфераз (АСАТ та АЛАТ), лактатдегідрогенази, креатинфосфокінази (КФК, креатинкіназа), альдолази, лужної фосфатази, амілази та деяких інших, а також ізоферментів (ЛДГ, КФК, лужної фосфатази, амілази та ін.).
Існують різноманітні методи визначення активності ферментів, у яких використовуються спектрофотометричні, флюорометричні, фотометричні методи. Для визначення актив-ності ізоферментів, наприклад, ЛДГ та КФК, використовують імунологічні, хроматографічні та електрофоретичні методи.
Інтерпретація результатів досліджень активності ферментів має певні труднощі, тому лікар повинен мати чітке уявлення про участь ферменту в метаболічних перетвореннях, можливих причинах змін активності, бути інформованим про методи, які були використані для аналізу активності ферменту та вміти використовувати отримані результати в комплексі з аналізом ін-ших показників крові та сечі і клінічної картини захворювання.






