Схема катаболизма
Липиды Гликоген-крахмал Белки
 | |||||||
 |  |  | |||||
Жирные Глицерин Глюкоза Аминокислоты
 | |||||||||
 |  |  |  | ||||||
 Ацето глицерофосфат Фруктоза – 1,6 дифосфат
Ацето глицерофосфат Фруктоза – 1,6 дифосфат
 цетил-КоА
цетил-КоА

Глицеральдегид – 3 фосфат
Пируват Пируват
СО2 Н2О +3 АТФ


 Ацетио – КоА Ацетил –КоА Ацетил- КоА
Ацетио – КоА Ацетил –КоА Ацетил- КоА
+
 Оксалоацетат Оксалоацетат
Оксалоацетат Оксалоацетат
 | |||
 | |||
 -Н2О+ 3 АТФ
-Н2О+ 3 АТФ
Цитрил- КоА Малат
 | |||
 | |||
Цитрат Фумарат
 |  |
 - Н2О+ 2 АТФ
- Н2О+ 2 АТФ

 Изоцитрат Сукцинат
Изоцитрат Сукцинат
 Н2О + 3 АТФ ГТФ
Н2О + 3 АТФ ГТФ
 Оксалосукцинат Сукцинил- КоА
Оксалосукцинат Сукцинил- КоА


 -Н2О+ 3АТФ
-Н2О+ 3АТФ
СО2 Альфа-кетоглутарат
7. Общие принципы регуляции метаболизма. Регуляция метаболизма на клеточном и субклеточном уровнях осуществляется прежде всего путем регуляции синтеза и каталитической активности ферментов. К таким регуляторным механизмам относятся: подавление синтеза ферментов. К таким регуляторным механизмам относятся: подавление синтеза ферментов конечным продуктом метаболич.пути, индукция синтеза одного или более ферментов субстратами, модуляция активности уже присутствующих молекул ферментов, в том числе алоостерическая регуляция. Большое значение имеет также регуляция скорости поступления метаболитов в клетку, где ведущую роль играют био.мембраны, окружающие цитоплазму и находящиеся в ней ядро, митохондрии, лизосомы и другие субклточные органеллы. Важнейшим средством, с помощью которого осущ-ся регуляция обмена веществ в живых организмах, являются гормоны. Особая роль в механизме действия гормонов принадлежит циклическим нуклеотидам.
8Основные конечные продукты метаболизма. В ходе многочисленных реакции метаболизма в клетках накапливаются вещества, которые оказываются непригодными для дальнейшего использования и подлежат выведению из организма. Эти вещества называют конечными продуктами обмена веществ. К ним относятся (вода,СО2, мочевинв, мочевая кислота, креатинин, индикан и минеральные соли). Выведение конечных продуктов обмена из организма человека происходит главным образом почками с мочей. Углекислый газ и вода выводятся из организма через легкие с выдыхаемым воздухом. Частично, вода и минеральные соли могут выводиться через кожу при потоотделении. Продукты распада гема (биллирубин, стеркобилин), холестерини другие стеройды(половые гормоны), некоторе мин.в-ва выводятся из организма печенью в состав желчи. В норме за сутки организма взрослогочеловека выводится около 1000 грамм СО2 2,0-2,5 литра воды, до 30 грамм минеральных солей, 35-40 грамм органических низкомолекулярных азотсодержащих соединений. За сутки с мочой выводится 25-30 мочевины, 0.7-0.8 грамм мочевой кислоты, 1.5 грамма креатинина, 0.7гр гиппуровой кислоты, 5- 25 мкг индикана. При патологических состояниях выедение конечных продуктов может быть увеличено, например воды при несахарном и сахарном диабете, мочевой кислоты при подагре, кальций и фосфор при рахите и тд. В ряде случаев может иметь место задержка конечных продуктов обмена в-в в организме повышениеих концентрации в крови и в тканях. Например при нефрите уменьшается выведение воды и азотсодержащих конечных метаболитов(мочевина, мочевая кислота, аммонийные соли и др) с мочой, что приводит к отравлению организма,к уремии.
9. Основные типы окисления Микросомальное окисление осущ-ся ферментнми системами, локализованными преимущественно во фракциях микросом печени и надпочечников. В процессах микросомального окисления активированный кислород непосредственно внедряется в окисляемое вещество. Микросомальное окисление- механизм использования кислорода с «пластическими» целями. Ферментативные системы, локализованные в микросомной фракции и способные использовать молекулярный кислород для окисления специфичесих органических соединений, делятся на 2 группы: диоксегеназы и монооксигеназы. Диоксегеназы катализируют реакции, в которых в мелкулу органического субстрата вкл.оба атома молекулы кислорода А+О2 à АО2. Монооксигеназы присоединяют к субстрату только 1 из двух атомов кислорода. Обычно поставщиком атомов водорода для восстановления второго атома килорода до воды служит НАДФН» анпример: RH + O2 + НАДФН2 àRОH+ Н2О + НАДФ.
Оксидазного типа происходит на мемранах эндоплазматического ретикулума и во внутр.мембране митохондрии.Ферменты- Оксидазы. По строению яв-ся металлофлавопротеинами.Находятся оксидахы в пероксисомах. Отнимают Н2 от субстрата и передают его на О2 с образованием Н2О2-перикиси водорода. Эти ферменты обычно обладают широкой субстратной специфичностью и невысокой активностью.
Пероксидное окисление липидов (ПОЛ) — один из наиболее важных окислительных процессов в организме. Это естественный метаболический процесс. Он необходим для осуществления процессов обновления липидов мембран, синтеза метаболитов арахидоновой
кислоты, являющихся биорегуляторами; активации макрофагов, разрушения чужеродных веществ, попавших в организм, уничтожения переродившихся клеток и т. д. При ряде патологических состояний (хроническом стрессе, действии жесткого ультрафиолетового света, ионизирующего излучения, лучевой болезни, канцерогенезе и др.) происходит активация ПОЛ.
10Макроэргические соединения. К макроэргическим соединения относятся АТФ и другие нуклеотид- 5- трифосфат, креатинфосфат, 1,3- дифофоглицерат, фосфоенолпируват. Из всех макроэргов Атф- главный хим.посредник клетки, связывающий между собой процессы идущие с выдлением и поглощением энергии(катаболизма, анаболизма), служит общим промежуточным продуктом в реакиях переноса энергии с фосфатными группами, используется для обеспечения энергией мышечного сокращения, для активного транспорта через мембраны, поставляет энергию для биолюминесценции и др. АТФ – постоянный универсальный носитель энергии для клетки. Роль АТФ можно сравнить с ролью аккумулятора. Он мобилен и может доставлять хим.энергию в любую часть клетки. Когда клетка нуждается в энергии, единственное, что требуется для ее получения- это гидролиз АТФ. АТФ+ Н2О АТФ-аза à АДФ+Н3РО4 + своб.энерг à идет на работу
11) Понятие о тканевом дыхании и биологическом окислении. Высвобождение свободной энергии при катаболизме углеводов, липидов и аминокислот может происходить в животном организме в аэробных и анаэробных условиях. Энергетически более выгоден аэробный путь катаболизма, который сопровождается в обязательном порядке поглощением тканями кислорода и выделением углекислого газа, т.е явление называемое тканевое дыхание или внутреннее, клеточное дыхание. В основе биологического окисления различных энергетических субстратов, как показали исследования, лежат три след. Типа реакций:1.перенос электронов2.перенос атомов водорода3.перенос атомов кислорода Основными энергетическими субстратами служат углеводы и жиры. Так клетки головного мозга млекопитающих вообще не способны использовать для клеточного дыхания, ничего кроме глюкозы. Окисление глюкозы в клетке, как главного энергетического субстрата, происходит путем последовательных реакций дегидрирования. При этом в анаэробных условиях окисление глюкозы завершается образованием двух молекул пирувата, которые восстанавливаются в две молекулы лактата. В аэробных условиях, образующиеся в цитозоле при гликолизе две молекулы пирувата подвергаются в митохондриях окислительному декарбоксилированию с образованием двух молекул ацетил КоА, которые разрушаются в цикле Кребса до углекислого газа и воды с высвобождением свободной энергии, трансформируемой ферментами дыхательной цепи митохондрий в макроэргические связи АТФ.
12. Дегидрирование субстратов и окисление водорода как источник энергии в клетке. Биологическое окисление это процесс дегидрирования субстрата с помощью промежуточных переносчиков водорода и его конечного акцептора. Если в роли конечного акцептора выступает кислород, процесс называется аэробным окислением или тканевым дыханием, если конечный акцептор представлен не кислородом анаэробным окислением. Анаэробное окисление имеет ограниченное значение в организме человека. Основная функция биологического окисления обеспечение клетки энергией в доступной форме. Тканевое дыхание процесс окисления водорода кислородом до воды ферментами цепи тканевого дыхания. Оно протекает по следующей схеме: Вещество окисляется, если отдает электроны или одновременно электроны и протоны (атомы водорода), или присоединяет кислород. Способность молекулы отдавать электроны другой молекуле определяется окислительно-восстановительным потенциалом (редокс-потенциалом). Любое соединение может отдавать электроны только веществу с более высоким окислительно-восстановительным потенциалом. Окислитель и восстановитель всегда образуют сопряженную пару.
13.Строение митохондрий и структурная организация цепи переноса электронов и протонов. Митохондрии имеются во всех эукариотических клетках. Эти органеллы главное место аэробной дыхательной активности клетки. Число митохондрий в клетке очень непостоянно и зависит от вида и природы клеток. Чрезвычайно варьируют размеры и форма митохондрий. Они могут быть овальными, округлыми, вытянутыми, спиральными и даже разветвленными. Длина митохондрий колеблется в пределах 1,5-10 мкм, а ширина 0,25-1,0 мкм. Митохондрии могут изменить свою форму. Каждая митохондрия окружена двумя мембранами. Наружную мембрану отделяет от внутренней расстояние в 6-10нм. Внутренняя мембрана заключаетя себе полужесткий матрикс митохондрий и образует многочисленные гребневые складки кристы. Внутренняя мембрана отличается избирательной проницаемостью. Митохондрии любой клетки быстро и очень экономно осуществляют процесс окисления различных субстратов путем отщепления атома водорода, разбивают его на протон и электрон и тем самым обеспечивают трансформацию химической энергии субстратов вначале в электрохимический потенциал градиента концентрации протонов на мембране, затем на процесс окислительного фосфорилирования, завершающийся синтезом АТФ. Этот процесс включает несколько этапов, в котором участвует ряд промежуточных ферментов переносчиков протонов и электронов на конечный акцептор-кислород, образующих дыхательную митохондриальную цепь. Путь протонов и электронов атома расходится. Перенос электронов осуществляется с помощью цитохромов b,c1,c,a и a3. Комплекс цитохромов b и c1 функционирует как КоQH- дегидрогеназа, которая осуществляет перенос электронов на цитохром c. Протоны при этом переходят в раствор. Перемещение электронов и протонов происходит по градиенту окислительно-восстановительного потенциала, который отражает величину свободной энергии окисления в соответствующей редокс-системе.
14. Дегидрогеназы и первичные акцепторы водорода - НАД и флавопротеиды; НАДН-дегидрогеназы. В тканях никатиновая кислота и никотинамид используется для синтеза коферментов НАД и НАДФ. Синтез НАД может идти непосредственно из триптофана через стадию образования кинуренина, 3-гидрооксикинунерина идр. НАД используется как субстрат ДНК-лигазной реакйции, т.е синтеза ДНК. НАД и НАДФ являются аллостерическими регуляторами ферментов цикла Кребса, ключевых ферментов глюконеогенеза. Никотинамидадениндинуклеоти́д (НАД, NAD) — кофермент, присутствующий во всех живых клетках, входит в состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить их на другие вещества. Представляет собой динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови. Отличие его от другого важнейшего кофермента — никотинамидадениндинуклеотидфосфата, или NADP, в том, что последний содержит в молекуле ещё один остаток фосфорной кислоты, связанной с 21-углеродным атомом рибозы. НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
15. Терминальное окисление: убихинон, цитохромы. Цитохромоксидаза. Цитохромы — это гемопротеины — белки, содержащие в качестве прочно связанной простетической группы гем:

Убихинон (как окисленный, так и восстановленный) совершенно нерастворим в воде, но хорошо растворяется в средах с низкой диэлектрической постоянной ("жирные" среды). Длинный хвост убихинона, по-видимому, вытянут в плоскости гидрофобного слоя мембраны, а активная голова может располагаться либо в той же плоскости, либо приближаться к поверхностям мембраны, контактирующим с водными фазами. Важное свойство убихинона, которое понадобится нам при дальнейшем рассмотрении, состоит в том, что его голова может восстанавливаться ступенчато, принимая последовательно по одному электрону (и протону).
Убихинон (кофермент Q) — производное изопрена:

Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:

Цитохромоксидаза переносит электроны с цитохрома С на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в геме цитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохрома а3, происходит на молекуле фермента. Каждый из атомов молекулы кислорода присоединяет по два электрона и протона, образуя при этом молекулу воды. Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов на нескольких стадиях, однако, не совсем ясны их локализация и механизм действия.
16.Механизмы трансформации энергии в клетке Согласно предложенной П. Митчеллом гипотезе, движущей силой фосфорилирования АДФ служит энергия разности редокс-потенциалов, возникающая при переносе электронов от окисляемого субстрата по дыхательной цепи к кислороду трансформируемая в энергию протонного электрохимического потенциала (dM H+), возникающая на внутренней мембране митохондрий. За счет протонов отщепляемых от окисляемых субстратов и накопления их тна наружной стороне мембраны митохондрий, она оказывается электроположительной, а со стороны митохондриального матрикса заряжается элктроотрицательно. Ионы Н+, выведенный наружу, под воздействием электроосмотических сил устремляются внутрь, в митохондриальный матрикс через специальные протонный каналы, в которых функционирует Н+ - АТФ синтетаза. Переход ионов Н+ с более высокой в зону с более низкой их концентрацией сопровождается выделением свободной энергии, за счет которой и сетезируется АТФ. До определенного времени считалось что АТФ и только АТФ выполняет универсальную аккумулирующую энергию функцию в клетке. Однако исследованиями В,П Скулачева и другими биоэнергетиками было устанолено что трансмембранный электрохимический потенциал, возникающий на мембране за счет Н+ градиента является универсальной формой энергии в клетке и может быть использован: -для синтеза АТФ; - для транспорта ионов кальция и др. ионов; - для транспорта фосфатов; - для транспорта АДФ и АТФ; - для теплообразования; - для сократительной и двигательной активности.В нормальной функционирующей клетке процесс трансформации энергии и степень окислительного фосфорилирования зависит от целого ряда факторов: от целостности митохондриальной мембраны, от типа окисляемого субстрата, от уровня кислорода, доставки неорганического фосфата и уровня АДФ.
17.Регуляция цепи переноса электронов и протонов (дыхательный контроль). Согласно предложенной Митчелом гипотезе, движущей силой фосфорилирования АДФ служит энергия разности редокс-потенциалов, возникающая при переносе электронов от окисляемого субстрата по дыхательной цепи к кислороду и трансформируемой в энергию протонного электрохимического потенциала (dMH+), возникающего на внутренней мембране митохондрий.За счет протонов отщепляемых от окисляемых субстратов и накопления их на наружной стороне мембраны митохондрий, она оказывается электроположительной, а со стороны митохондриального матрикс через специальные протонные каналы, в которых функционирует H+-АТФ синтетаза
18Окислительное фосфорилирование. При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одного до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ. Это процесс - процесс синтеза АТФ в реакциях биологического окисления субстратов получил название - окислительное фосфорилирование. Для его количественной оценки был введен показатель окислительного фосфорилирования - коэффициент Р/О. Коэффициент Р/О (АДФ/О) - это есть отношение количества молекул фосфорной кислоты (АДФ) к количеству атомов кислорода использованных митохондриями при окислении какого-либо субстрата.
19Разобщение тканевого дыхания и окис.фосфор.е. Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Некоторые химические вещества (протонофоры) могут переносить протоны и другие ионы (ионофоры) из мембранного пространста через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается, что приводит к возрастанию скорости окисления НАДН и ФАДН2, возрастает и количество поглощенного кислорода, но энергия выделяется в виде тепла, и коэффициент Р/О резко снижается (свободное окисление). Разобщители – липофильные вещества, легко проходящие через липидный слой мембраны: - 2,4-динитрофенол, - дикумарол (антивитамин вит. К); - билирубин (продукт распада гема); - тироксин (гормон щитовидной железы). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
20.Терморегуляторная функция тканевого дыхания. Гипоэнергетические состояния возникают: 1) при нарушении поступления субстратов для дегидрирования (на всех этапах от пищи до матрикса митохондрий); 2) при нарушении поступления О2 в митохондрии (на всех этапах от дыхания, связь с НЬ, транспорт и др.); 3) при нарушении мембран митохондрий, композиции липидного бислоя и ферментативных ансамблейвнутренней мембраны митохондрий. Живая клетка нуждается в АТФ непрерывно, поскольку разнообразные процессы, связанные с использованием АТФ, в клетке никогда не прекращаются. Например, для обновления белков расходуется около 15 % всей энергии основного обмена (т. е. обмена в состоянии покоя), на поддержание трансмембранного градиента концентраций ионов натрия и калия — около 30 %. При переходе к мышечной активности потребность в АТФ многократно увеличивается. Запасов АТФ в клетке практически не создается. Например, в сердечной мышце АТФ истощается за несколько секунд, если блокирован его синтез. Следовательно, клетка непрерывно должна получать пищевые вещества (доноры водорода) и кислород для поддержания синтеза АТФ. При голодании в качестве источников энергии используются собственные вещества тканей. Энергетический обмен в этих условиях снижен: через две недели голодания потребление кислорода уменьшается на 40 % (алиментарная форма гипоэнергетического состояния). Резервов пищевых веществ в организме хватает на несколько недель полного голодания, запасов же кислорода нет, поэтому при лишении кислорода уже через 2-3 мин наступает смерть. Гипоксия — наиболее частая причина гипоэнергетических состояний (табл. 8.5), а гипоксия мозга — наиболее частая непосредственная (последняя) причина смерти. Поэтому среди реанимационных процедур ведущее место занимают меры, направленные на восстановление снабжения органов кислородом.
21).Понятие о специфических и общих путях катаболизма. Окислительное декарбоксилирование пировиноградной кислоты. Специфические и общие пути катаболизма. В катаболических процессах можно выделить два звена: - специфические пути катаболизма, разные для различных классов соединений (белков, жиров, углеводов и др.), - общие пути катаболизма - единые пути катаболизма для различных классов веществ, являющиеся продолжением специфических путей. С общими путями катаболизма, в основном, связаны главные биоэнергетические процессы, сопряженные с высвобождением и накоплением энергии в клетке.К специфическим путям катаболизма относятся реакции гидролиза белков, углеводов, липидов происходящие в желудочно-кишечном тракте или в тканях, реакции разрушения моносахаридов, аминокислот, жирных кислот, спиртов, происходящие в клетках и, в конце концов, завершающиеся образованием пировиноградной кислоты или ацетильным радикалом в форме ацетил-КоА.
Окислительное декарбоксилирование пировиноградной кислоты
Окислительное декарбоксилирование пирувата катализируется мультиэнзимным пируват-дегидрогеназным комплексом, локализованным на внутренней мембране митохондрий со стороны матрикса. Пируват-дегидрогеназный комплекс (окислительная декарбоксилаза пировиноградной кислоты) состоит из трех ферментов (Е1,Е2,Е3): Е1-пируватдекарбоксилаза с коферментом ТПФ (тиаминпирофосфат), Е2-дигидролипоил-трансацетилаза с коферментом липоевая кислота (ЛК) и кофактором - НS-КоА, Е3-дигидролипоил-дегидрогеназа с коферментом ФАД и кофактор -НАД Пировиноградная кислота (пируват) и ацетил-КоА являются теми метаболитами, которые, включаясь в общие пути катаболизма, разрушаются до углекислого газа и воды, поставляют энергию для синтеза АТФ в митохондриях. К общим путям катаболизма относятся следующие метаболические процессы (оба эти процесса локализованы в митохондриях): - окислительное декарбоксилирования пировиноградной кислоты; - превращение ацетил-КоА в цикле трикарбоновых кислот Кребса (Ц Т К).Пируват (пировиноградная кислота) является одним из центральных метаболитов углеводного обмена. При окислительном декарбоксилировании пирувата образуется ацетил-КоА - ключевой субтсрат цикла трикарбоновых кислот Кребса. В анаэробных условиях из пирувата образуется молочная кислота. В процессе глюконеогенеза из пируват синтезируется глюкоза. Повышение уровня пирувата наблюдается при гиповитаминозе В1, при интенсивной мышечной работе, при сердечной декомпенсации, сахарном диабете, при гепатитах. В ликворе концентрация пирувата резко повышается после черепно-мозговой травмы, при менингите, абсцессе мозга.
Окисление пирувата



Цикл трикарбоновых кислот. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
Цикл трикарбоновых кислот

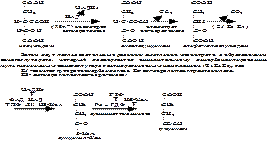
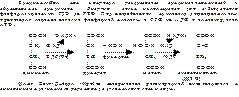
Всего во всех общих реакциях катаболизма при переносе протонов и эллектроггов по дыхательной цепи к кислороду синтезируется 15 молекул АТФ и образуется 5 молекул воды. При этом по ходу окисления ацетильного радикала, фермента, цикла Кребса используют две молекулы воды и молекулу неоргонического фосфата для производства 5 атомов водорода. Таким образом общие пути катаболизма и цепь переносов электронов и протонов митохондрий представляют собой единый процесс обеспечив эрги клеток и организм в целом.






