Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона - изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют "инсулинглюкагоновый индекс". В постабсорбтивном периоде инсулинглюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ - глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
Адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) "топливом" в экстремальной ситуации. Эффект адреналина в печени обусловлен фосфорилированием (и активацией) гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия (рис. 7-29). Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени (рис. 7-30).
Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с
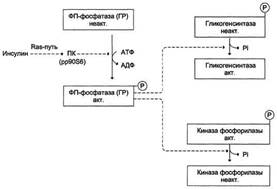
Рис. 7-28. Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) - фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) - протеинкиназа, активируемая инсулином.
которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с α1-рецепторами "включают" инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем - фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
В период пищеварения преобладает влияние инсулина, так как инсулинглюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
- снижает уровень цАМФ в клетках, фосфорилируя (опосредованно через Ras-путь) и тем самым активируя протеинкиназу В (цАМФ-независимую). Протеинкиназа В, в свою очередь, фосфорилирует и активирует фосфодиэстеразу цАМФ - фермент, гидролизующий цАМФ с образованием АМФ. Механизм влияния инсулина на уровень цАМФ в клетке подробнее будет изложен в разделе 11;
- активирует (через Ras-путь) фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
- индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке. Следует напомнить, что регуляторным фактором в метаболизме гликогена является также величина Кm глюкокиназы, которая много выше, чем Кm гексокиназы. Смысл этих различий понятен: печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы.
Всё это вместе приводит к тому, что инсулин одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, переключая процесс мобилизации гликогена на его синтез.
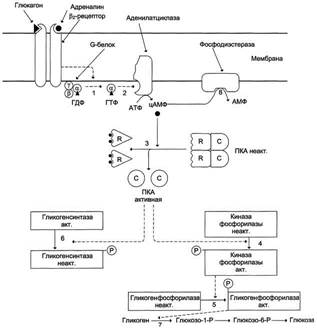
Рис. 7-29. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
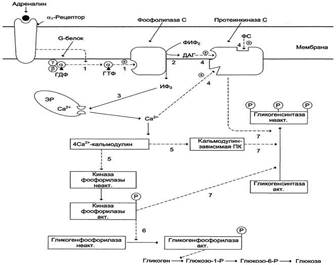
Рис.7-30. Регуляция синтеза и распада гликогена в печени адреналином и Са2+. ФИФ2- фосфатидилинозитолбисфосфат; ИФ3- инозитол-1,4,5-трифосфат; ДАГ - диацилглицерол; ЭР - эндоплазматический ретикулум; ФС - фосфодитилсерин. 1 - взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 - фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ; 3 - ИФ3 активирует мобилизацию Са2+ из ЭР; 4 - Са2+, ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулин-зависимые протеинкиназы; 6 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 - активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
В печени существует и аллостерическая регуляция гликогенфосфорилазы, обеспечивающая внутриклеточные потребности в глюкозе, но гормональные сигналы имеют приоритет над внутриклеточными и преследуют другие физиологические цели. Ранее (см. раздел 6) рассматривалось значение изменения в клетке уровней АТФ, АДФ и АМФ как показателя, отражающего потребности клетки в энергии. Замедление утилизации АТФ сопровождается снижением активности гликогенфосфорилазы и уменьшением скорости распада гликогена. Напротив, увеличение расходования АТФ ведёт к повышению уровня АМФ, активации гликогенфосфорилазы и ускорению распада гликогена. АТФ и АМФ являются аллостерическими эффекторами по отношению к гликогенфосфорилазе. Существует также и метаболический контроль активности гликогенфосфорилазы. Так, при повышении концентрации глюкозо-6-фосфата активность этого фермента в клетках печени снижается.






