Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат.
Так как лейцин, изолейцин и валин имеют сходную структуру, их катаболизм на первых этапах идет по общему пути. Затем этот путь разветвляется, и скелет каждой аминокислоты трансформируется по собственному пути с образованием амфиболических интермедиатов (рис. 2, 3). В зависимости от природы этих амфиболических конечных продуктов аминокислоты относят к типу гликогенных (валин), кетогенных (лейцин) или к обоим типам (изолейцин). В силу сходства начальных реакций катаболизма всех трех аминокислот их удобно рассматривать вместе (рис. 2).
Рисунок 2 – катаболизм аминокислот с разветвленной цепью у млекопитающих.
Реакции 1-3 – общие для всех трех аминокислот; далее пути их катаболизма расходятся. Перечеркнутые стрелки показывают стадии, на которых метаболизм блокирован в случае двух редко встречающихся заболеваний: 2 – болезни «кленового сиропа» (нарушен катаболизм всех трех аминокислот), 3 – изовалериановой ацидемии (нарушен катаболизм лейцина).
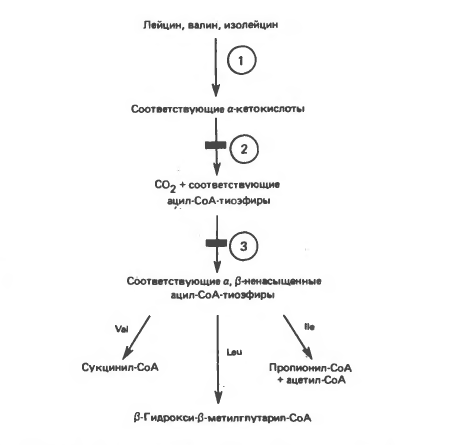
А. Переаминирование. Обратимое переаминирование (реакция 1, рисунок 2) всех трех разветвленных L-α-аминокислот в тканях млекопитающих осуществляется, вероятно, одной и той же трансаминазой. Обратимостью этой реакции объясняется возможность замены в диете L-α-аминокислот соответствующими a-кетокислотами, если организму доступны адекватные источники азота.
Б. Окислительное декарбоксилирование с образованием ацил-СоА-тиоэфиров. Эта реакция (реакция 2, рисунок 2) аналогична окислению пирувата до ацетил-СоА и СО2 пируватдегидрогеназой и окислению α-кетоглутарата до СО2 и сукцинил-СоА
α-кетоглутаратдегидрогеназой. У млекопитающих дегидрогеназа разветвленных
α-кетокислот является митохондриальным мультиферментным комплексом, катализирующим окислительное декарбоксилирование α-кетоизокапроата
(из лейцина), α-кето-Р-метилвалерата (из изолейцина) и а-кетоизовалерата (из валина). Субъединицы дегидрогеназного комплекса α-кетокислот аналогичны соответствующим субъединицам пируватдегидрогеназы. Комплекс включает субъединицы с декарбоксилазной (по отношению к α-кетокислотам), трансацилазной и дигидролипоилдегидрогеназной активностями. Как и в случае пируватдегидрогеназы, данный комплекс инактивируется при фосфорилировании за счет АТР в реакции, катализируемой протеинкиназой.
Независимая фосфопротеинфосфатаза катализирует дефосфорилирование комплекса и, следовательно, реактивирует его. Таким образом, перевод фермента
в фосфорилированное состояние может регулировать катаболизм аминокислот с разветвленной цепью. Протеинкиназа ингибируется ADP, α-кетокислотами с разветвленной цепью, гиполипидемическим агентом клофибратом и дихлорацетатом, а также тиоэфирами кофермента А (например, ацетоацетил-СоА). Из разветвленных α-кетокислот самым сильным ингибитором является
α-кетоизокапроат (а-кетолейцин).
В. Дегидрогенирование с образованием α-, β-ненасыщенных тиоэфиров ацил-СоА. Эта реакция (реакция 3, рисунок 2) аналогична дегидрогенированию линейных ацил-СоА тиоэфиров в процессе катаболизма жирных кислот. Пока неизвестно, катализирует ли дегидрогенирование всех трех разветвленных ацил-СоА тиоэфиров одна
и та же дегидрогеназа. Косвенные данные указывают на участие по крайней мере двух ферментов; они основаны на обследовании пациентов с изовалериановой ацидемией, у которых после приема обогащенной белком пищи в крови накапливается изовалерат; при этом содержание других разветвленных a-кетокислот не повышается.
Реакции, специфичные для катаболизма лейцина (рис. 3,4).
Рисунок 3 – реакции катаболизма лейцина.
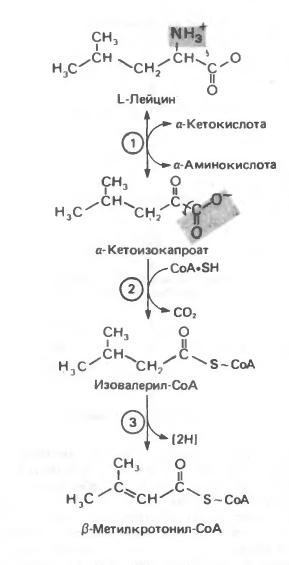
Реакция 4L: карбоксилирование Р-метилкротонил- СоА.
Ключевым наблюдением, позволившим объяснить кетогенное действие лейцина, было обнаружение того факта, что при превращении концевой изопропильной группы лейцина в ацетоацетат происходит «фиксация» (т.е. ковалентное связывание) 1 моля СО2 на моль изопропильных групп. Этой фиксации (реакция 4L, рис. 4) предшествует осуществляемое за счет энергии АТР присоединение СО2 к связанному с ферментом биотину с образованием биотинил-СО2. В результате фиксации СО2 образуется интермедиат β-метилглутаконил-СоА.
Рисунок 4 – катаболизм β-метилкротонил-СоА, образующегося из L-лейцина
(см. рис. 3). Звездочкой отмечены атомы углерода, поступившие из СО2.
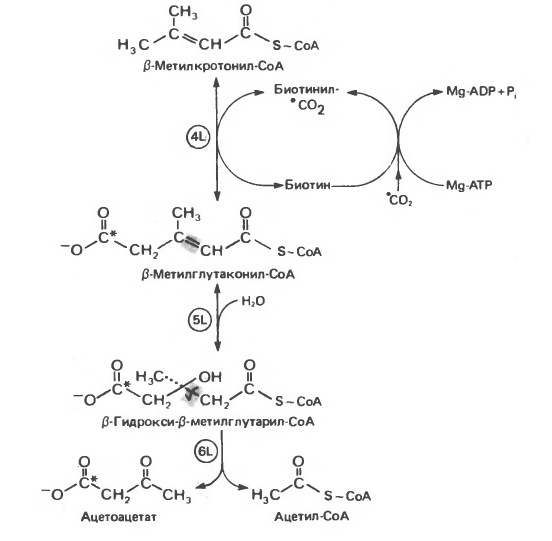
Реакция 5L: присоединение воды по двойной связи β-метилглутаконил-СоА. Продукт реакции β-гидрокси- β-метилглутарил-СоА служит предшественником не только кетоновых тел (реакция 6L, рис. 4), но также и мевалоната, который далее может превращаться в холестерол и другие полиизопреноиды.
Реакция 6L: расщепление β-гидрокси- β-метилглутарил-СоА. Реакция, в ходе которой из β-гидрокси- β-метилглутарил-СоА образуются ацетил-СоА и ацетоацетат, протекает у млекопитающих в митохондриях клеток печени, почек и сердца. Этим процессом объясняется сильное кетогенное действие лейцина, поскольку на 1 моль лейцина наряду с 1 молем ацетоацетата образуется опосредованно еще 1/2 моля кетоновых тел из ацетил-СоА.






