Барлық белокты бірдей бөліп алатындай әдіс жоқ. Белоктардың биологиялық қызметін, құрылымын зерттеу үшін және оларға рентгендік құрылымдық талдау жасау үшін 100 мг ғана белок жеткілікті.
Белокты бөліп алу үшін ең алдымен оған аммоний сульфатымен, этанолмен немесе ацетонмен әсер етіп, қан сарысуынан глобулин белогын тұнбаға шөктіреді, бұл кезде басқа белоктар ерітіндіде қалады. Белоктарды бір-бірінен осындай қарапайым жолмен ажыратып бөледі. Ары қарай хроматография, электрофорез, изоэлектрофокустау сияқты әдістер бойынша жүргізіледі:
Материалды ұсақтау + құм, шыны + буфер ерітіндісі → центрифугалау → экстрактты бөліп алу + (NH4)2SO4 + центрифугалау → тұнба + буфер → диализ → гель-фильтрация (сефадекс).
Хроматографиялық әдісі қоспалардың адсорбция және десорбция кезектесуіне негізделген. Хромотографиялық адсорбция, ажырататын бөлгіш, ион алмасатын және гель-сүзгіш сияқты түрлері бар. Әдістің шарты – бөліп ажырататын заттарды әртүрлі екі компонентті жүйеге қозғалмалы және қозғалмайтын фазаларға орналастырады. Белоктарды ажыратып бөлу үшін бағаналық хромотографияны пайдаланады. Ол үшін ерітіндідегі белоктар қоспасын шыны бағана арқылы өткізеді.
Гель-сүзгі әдісі бойынша хромотографиялау әдісі ДЭАЭ-сефадекстің (полисахарид) әртүрлі маркаларымен жүреді. Мұндай сүзгіден белоктардың өту жылдамдығы олардың молекуласы шамасына байланысты. Гель-сүзгі молекулалық елек сияқты. Шағын молекулалы белоктар бағана арқылы өту кезінде сефадекс түйіршіктерінің ішіне енеді, ал ірілері түйіршіктердің аралығында жүреді. Осыған байланысты ірі молекулалы белоктар бағана арқылы тезірек өтеді де, бірінші болып шығады.
Аффиндік хроматография – белоктың белгілі бір химиялық заттар тобымен байланысы алатын өзіне ғана тән қасиетіне негізделген. Мысалы, белгілі бір белок глюкозаға жақын дейік. Сонда глюкозаны қатты стационар фазамен ковалентті түрде, мысалы сефарозамен байланыстырады. Гель-сүзгі жағдайы кезіндегі сияқты, бұл фазамен хромотографиялық бағананы толықтырады. Бұдан кейін бағана арқылы белоктар қоспасының ерітіндісін өткізеді. Бағанадағы иммоблизацияланған глюкозада осы белок қана ұсталып қалады, себебі глюкозамен туыстас. Ал басқа белоктар адсорбцияланбайды, оларды буферлік ерітінді ілестіріп алып кетеді. Осыдан кейін байланысқан белокты глюкозаның концентрациялы ерітіндісінің көмегімен бағанадан бөліп алады.
Изоэлектрлік фокустеу – белокты заттардың өте күрделі қоспаларын электрофорездік жолмен бөлудің жетілдірілген әдісі. Бұл әдіс қоршаған ортаның рН шамасына байланысты белок молекулалары зарядының өзгеруіне негізделген. Изоэлектрлік нүктеге жеткен кезде белок молекуласы зарядтарының саны нольге тең болатыны және бұл кезде электр өрістерінің әсерінен оның қозғала алмайтындығы белгілі.
Изоэлектрлік фокустеу барысында шыны бағананы полиакриламидтік гельмен толтырғанда ерекше буфердің әсерімен рН градиенті қалыптасады. Осыдан кейін гельдің үстіне белок қоспаларының ерітіндісі құйылады. Бұл кезде электр өрістерінің әсерінен әр белок өзінің изоэлектрлік нүктесіне сәйкес келетін рН градиенті аймағына ауысады да, сонда қозғалысын тоқтатып, қалып қояды. Осылайша белоктар қоспасы изоэлектрлік нүктесіне байланысты бөлініп, гель бағанасы бойына орналасады. Сөйтіп әр белок өзіне тиісті тар алқапта рН көрсеткіші бойынша шоғырланып орналасады. Осылайша бөлінген топтарын коллекторға жинақтайды да, рН көрсеткіші бойынша ажыратып алады.
Ферменттер, функциялары. Ферменттердің құрылысы. Бір- және екі компонентті ферменттердің ерекшеліктерін көрсетіңіз. Мысалдар келтіріңіз.
Ферменттер – организмде өтіп жатқан барлық зат алмасу реакцияларын, олардың қызметін, әрбір клетканың және тұтас организмнің әрекет байланыстарын реттейді.
Фермент – организмдегі түрлі химиялық реакцияларды тездетуші белоктық зат, биологиялық катализатор. Ферменттер өздері катализдейтін реакцияларға байланысты келесі топтарға бөлінеді, бұл топтар ферменттердің қызметтерін айқындайды.
1. Оксидоредуктазалар – тотығу-тотықсыздану реакциялары.
2. Трансферазалар – реакцияларда жеке атомдық топтарды тасымалдау.
3. Гидролазалар – судың қосылуымен химиялық байланыстарды үзу.
4. Липазалар – субстратты гидролиздік емес жолмен ыдыратып, қос байланыс түзу және керісінше реакциялар.
5. Изомеразалар - молекула ішіндегі өзгерістерді катализдеп, изомер түзу.
6. Лигазазалар – АТФ энергиясы арқылы екі әр түрлі қосылыстың конденсациясын катализдеп, С-С, С-O, C-N, C-S байланыстарын орнату.
Химиялық құрамы бойынша ферменттер екі топқа бөлінеді: қарапайым және күрделі.
Қарапайым ферменттер гидролиз кезінде амин қышқылдарына ғана ажырап бөлінеді: рибонуклеаза, пепсин, трипсин, химотрипсин т.б.
Күрделі ферменттер екі бөліктен: белоктық және белоктық емес бөліктен тұрады. Ферменттердің белоктық бөлігі – апофермент деп, ал белоктық емес бөлігі простетикалық топ немесе кофактор деп аталады. Апофермент кофакторсыз активті болмайды. Күрделі ферменттердің кофакторлары металл иондары немесе белоктық емес органикалық заттар. Мұндағы металл иондары активаторлар деп аталады: Na+, K+, Fe2+, Co2+ т.б.
Кофактор белоктық емес зат болғандықтан кофермент деп аталады. Ферменттің мықты байланысқан кофакторы – простетикалық топ. Көптеген ферменттердің активтігі үшін екі фактордың да – металл иондарының да, простетикалық топтың да болуы қажет.
Коферменттер – төменгі молекулалы заттар, олар жоғары температураға төзімді келеді және белоктық бөлігінен оңай ажырайды. Көптеген коферменттер витаминге жатады немесе витаминдер туындысы болып табылады: тиаминпирофосфат, никотинамидті коферменттер. Витаминдік емес коферменттер де бар: металлпорфириндер, нуклеотидтер, пептидтер.
Ферменттің құрамында белгілі бір кофактордың болуына байланысты ферменттер бір және екі компонентті болып бөлінеді. Күрделі белоктардың бір түрі ретіндегі 2 компонентті ферменттер(холоферменттер) белокты бөліктен(апоферменттен) және простетикалық топтан(коферменттен) тұрады. Протетикалық топ ферменттік реакцияға тікелей қатысады. Ал белокты бөлік ферменттің белсенділігін арттырады.
Біркомпонентті ферменттер – белсенділігі негізінен құрамындағы аминқышқылдарының орналасуына байланысты болатын кристалды белоктор.
Ферменттің белсенді орталығы,Ферменттердің өзіндік әсер етуі(мысалдар).Коферменттердің рөлі,олардың түрлерін мысалдармен көрсетіңіз.
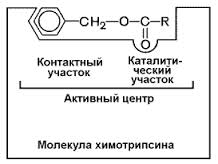
Ферменттің активті орталығы-фермент молекуласының субстратпен тікелей жанасып жатқан бөлігі.Ферменттің активті орталығы субстратпен байланысуға және ыдыратып өзгертуге міндетті.Активті орталық бүйір радикалында функционалды тобы бар амин қышқылдарының қалдықтарынан түзіледі.Күрделі ферменттерде активті орталыққа амин қышқылдарынан басқа металл иондары мен коферменттер кіреді.Олар катализ процесінде маңызды қызмет атқарады.Ферменттердің активті орталығында реакцияласуға қабілетті топтары бар мынадай амин қышқылдары кездеседі.1.цистеин,оның құрамында сульфгидильдік топ SH-бар,2.Серин,оның құрамында гидроксильдік топ-ОН бар,3.Гистидин,құрамында имидазол сақинасы бар,4.аспарагин қышқылы мен глутамин қышқылы-СООН бар,5.триптофан-индол бар,6.гидрофобты амин қышқылдары.Активті орталық фермент молекуласының бетіндегі шағын ғана бөлік.Ферменттегі а.қ. қалдықтарының үлкен бөлігі орталық активтілігіне әсер етпейді.Активті орталық нүктеде емес,сызықшаға да ұқсамайды,кеңістіктік пішінді,ол ферменттің полипептидтік тізбегінде бірінен-бірі қашық орналасқан жеке а.қ.-ның өзара жақындасуынан пайда болады.Мәселен,химотрипсиннің активті орталығын қарастырайық.Оның молекуласы 241 а.қ. қалдықтарынан тұрады.Мұның молекуласында сериннің 26 қалдығы бар,ал катализдік активтілік үшін олардың біреуі жеткілікті.Химотрипсиннің ферменттік активтілігіне маңыздылар:Гис-57,Асп-102,Сер-195.Гистидин сутектік б-с арқылы серинмен,аспарагинмен жалғасады.Осының нәтижесінде полипептидтік тізбектегі жеке учаскелер жақындасады,екіншілік және үшіншілік құрылым түзеді,фермент активті болады.Суббөліктен тұратын ферментте активті орталық біреу ғана емес,екеу және одан да көп болады.Мысалы бауырдың алкогольдегидрогеназа ферменті мырыштың екі атомынан және НАД+ тың екі молекуласынан тұрады,активті орталығы да екеу.Ферменттегі осы активті орталықтың әр қайсысының өзіне тән катализдік активтілігі және тиісті әсері бар.Ферменттің активті орталығы 2 бөліктен тұрады:адсорбциялық,каталиттік.Адсорбциялық-субстратты таңдап алуына жауапты активті бөлігі.Каталиттік-каталитикалық процеске қатысатын активті орталық бөлігі.
8. 
Фермент әсері екі стадиядан тұрады.Біріншісінде фермент пен субстрат арасында комплекс фермент-субстрат түзіледі.Е+S=ES.Ол МИхаэлис комплексі деп аталады.Бұл қайтымды процесс.Реакцияның екінші сатысында фермент-субстрат комплексі ыдырайды да,реакцияның соңғы өнімдері түзіледі,ал фермент босап шығады.Босаған фермент субстраттың басқа молекулалармен байланысып,катализ реакциясы әрі қарай жүре береді.ES--  E+P1+P2.Фермент әсерінің мынадай ережелері бар:Реакция барысында фермент құрылымы өзгермейді.Фермент өте шағын мөлшерде әсер етеді.Фермент реакция тепе-теңдігін бұзбайды.Ферменттердің әсер ету механизмі-ферменттік реакциялардың әрбір кезеңінен толық жете баяндау.Ферменттің ерекшелігі-ферменттің өзіне тән субстратын тануы.Химотрипсиннің ферментінің әсер ету механизмі жақсы зерттелген.Оның ферментінің әсер ету механизмі мынадай.Ферменттің активті орталығында серин-195 бар,және онда бүйірлік топ-CH2OH.РЕакцияның басында фермент пен субстрат аралық комплекс түзілгеннен кейін серин қалдығындағы гидроксил топтың оттегі атомы субстраттағы көміртегінің карбонильдік атомына шабуыл жасайды.Фермент-субстрат арасындағы б-с үзіледі.Ацильденген фермент пен реакция өнімдерінің біреуі ғана пайда болады.Катализдің 2-ші кезеңінде су молекуласының қатысуымен фермент тотықсызданады да,реакцияның екінші өнімі бөлініп шығады.Реакция нәтижесінде бөлініп шыққан фермент келесі катализдік циклды жүргізуге дайын болады.Коферменттер-құрамында белок жоқ органикалық қосылыстар,олар апоферментпен тығыз байланысқан.Коферменттер-төменгі молекулалы заттар,жоғары температураға төзімді келеді,ферменттің белоктық бөлігінен оңай ажырайды.Көптеген коферменттер витаминге жатады.Биохимиялық реакцияларда коферменттер екі түрлі қызмет атқарады.Күрделі фермент құрамында субстраттың катализдік өңделіп өзгеруіне қатысады.Бір субстраттан екіншісіне электрон,протондарды тасымалдайды.НАД+ және НАДФ+ коферменттерінің активті бөлігі никотинамид болып табылады,ол пиридиндік коферменттер деп аталады.Олар әдетте клеткада бос күйінде болады.1 ферменттен екіншісіне ауысып отырады.Олар дегидрогеназалардың көпшілігінде тек катализдік реакция кезінде ғана ферменттің белоктық бөлігімен байланысады.НАД+ коферментіне қарағанда,НАДФ+коферментінде бір фосфат тобы артық болады,НАД+ пен НАДФ+ здерінің құрылымы жөнінде жақын қосылыс,бірінен-бірі түзіле алады,бірақ бірін-бірі алмастыра алмайды.НАД+ және НАДФ+ коферменттері гликолиз,клетка тыныстануы,фотосинтез сияқты процестерде,сол сияқты сүт қышқылды ашу мен спиртті ашу кездерінде маңызды қызмет атқарады.ФАД және ФМН флавиндік коферменттері әр түрлі апоферменттермен байланысады да,флавопротеинді ферменттер-флавиндік дегидрогеназа түзеді.Олардың НАД+ және НАДФ+ екеуінен айырмасы,катализдік реакция кезінде ферменттік белоктық бөлігіне байланысқан күйінде қалады.Сонымен қатар ТПФ коферменті апоферментпен байланысып,декарбоксилаза түзеді,ол кетоқышқылдан көмір қышқыл газдың бөлініп шығуын катализдейді.
E+P1+P2.Фермент әсерінің мынадай ережелері бар:Реакция барысында фермент құрылымы өзгермейді.Фермент өте шағын мөлшерде әсер етеді.Фермент реакция тепе-теңдігін бұзбайды.Ферменттердің әсер ету механизмі-ферменттік реакциялардың әрбір кезеңінен толық жете баяндау.Ферменттің ерекшелігі-ферменттің өзіне тән субстратын тануы.Химотрипсиннің ферментінің әсер ету механизмі жақсы зерттелген.Оның ферментінің әсер ету механизмі мынадай.Ферменттің активті орталығында серин-195 бар,және онда бүйірлік топ-CH2OH.РЕакцияның басында фермент пен субстрат аралық комплекс түзілгеннен кейін серин қалдығындағы гидроксил топтың оттегі атомы субстраттағы көміртегінің карбонильдік атомына шабуыл жасайды.Фермент-субстрат арасындағы б-с үзіледі.Ацильденген фермент пен реакция өнімдерінің біреуі ғана пайда болады.Катализдің 2-ші кезеңінде су молекуласының қатысуымен фермент тотықсызданады да,реакцияның екінші өнімі бөлініп шығады.Реакция нәтижесінде бөлініп шыққан фермент келесі катализдік циклды жүргізуге дайын болады.Коферменттер-құрамында белок жоқ органикалық қосылыстар,олар апоферментпен тығыз байланысқан.Коферменттер-төменгі молекулалы заттар,жоғары температураға төзімді келеді,ферменттің белоктық бөлігінен оңай ажырайды.Көптеген коферменттер витаминге жатады.Биохимиялық реакцияларда коферменттер екі түрлі қызмет атқарады.Күрделі фермент құрамында субстраттың катализдік өңделіп өзгеруіне қатысады.Бір субстраттан екіншісіне электрон,протондарды тасымалдайды.НАД+ және НАДФ+ коферменттерінің активті бөлігі никотинамид болып табылады,ол пиридиндік коферменттер деп аталады.Олар әдетте клеткада бос күйінде болады.1 ферменттен екіншісіне ауысып отырады.Олар дегидрогеназалардың көпшілігінде тек катализдік реакция кезінде ғана ферменттің белоктық бөлігімен байланысады.НАД+ коферментіне қарағанда,НАДФ+коферментінде бір фосфат тобы артық болады,НАД+ пен НАДФ+ здерінің құрылымы жөнінде жақын қосылыс,бірінен-бірі түзіле алады,бірақ бірін-бірі алмастыра алмайды.НАД+ және НАДФ+ коферменттері гликолиз,клетка тыныстануы,фотосинтез сияқты процестерде,сол сияқты сүт қышқылды ашу мен спиртті ашу кездерінде маңызды қызмет атқарады.ФАД және ФМН флавиндік коферменттері әр түрлі апоферменттермен байланысады да,флавопротеинді ферменттер-флавиндік дегидрогеназа түзеді.Олардың НАД+ және НАДФ+ екеуінен айырмасы,катализдік реакция кезінде ферменттік белоктық бөлігіне байланысқан күйінде қалады.Сонымен қатар ТПФ коферменті апоферментпен байланысып,декарбоксилаза түзеді,ол кетоқышқылдан көмір қышқыл газдың бөлініп шығуын катализдейді.

Кобамидтік коферменттер болса өзіне сәйкес апоферменттермен қосылып,кобамидтік ференттер тобын құрайды.Олар метилкобамидті ферменттер трансметилдену процсеін катализдейді.Пиридоксиндік коферменттердің негізі В6 витамині,бұл кофермент құрамына бір-біріне ұқсас 3 қосылыс: пиридоксин,пиридоксаль,пиридоксамин кіреді.Ол үшеуі бір-біріне оңай айналады.Фолаттық коферменттер фолий қышқылының туындысы.Фолаттық коферменттер бір көміртекті топтарды бір молекуладан екіншісіне алмастырып отырады.А коферменті-ацетилдеу коферменті.Бұл кофермент сірке қышқылының қалдықтарын ауыстырып жеткізеді.Оның құрылысы күрделі.А коферменті құрамына пантотен қышқылы витамині кіреді.Липой қышқылы коферменті құрамында дисульфидтік топ бар.Ол топ тотығып,екі сульфгидрильдік топ құрайды да,дигидролипой қышқылына айналады.
9. 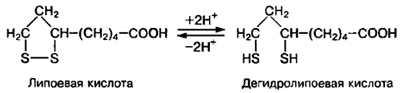 Q-коферменті/убихинон/.-барлық жерде деген мағына береді.Барлық клеткадан табылған.Убихинон молекуласындағы бензохинонға бүйірлік изопрен тізбегі жалғасқан,ондай тізбек 10 ретке дейін қайталанады.
Q-коферменті/убихинон/.-барлық жерде деген мағына береді.Барлық клеткадан табылған.Убихинон молекуласындағы бензохинонға бүйірлік изопрен тізбегі жалғасқан,ондай тізбек 10 ретке дейін қайталанады.
Ферменттік реакцияның жүру механизмі. Ферменттік реакциялардың түрлері(тура және кері реакция). Әртүрлі факторлардың ферметтік реакцияға әсерін көрсетіңіз.
Ферменттік әсерету механизмі. Химиялықреакциялардыңжылдамдығыреакцияғатүсетінмолекулалардыңсоқтығысужиілігінебайланысты. Алсоқтығысужиілігімолекулалардыңконцентрациясыменортаныңтемпературасынабайланысты.
Температураның артуына қарай молекулалар қозғалысыныңкинетикалық энергиясы да артады, бұл молекулалар соқтығысуының жиілігіне әсеретеді. Сонымен қатар реакцияныңөтуіүшінмолекулалардыңсоқтығысуыжеткіліксіз. Бұл кезде оларактивті күйде болуы қажет, басқаша айтқанда, олардареакция үшінқажетті энергияныңбіршама артық қорыболуы тиіс. Мұндайэнергияныактивацияэнергиясыдепатайды. Ферментосыреакцияғақажетактивацияэнергиясынкемітеді. Олүшінферментреакцияғаұшырайтынзаттыңмолекуласымен (онысубстратдепатайды)бірігіпкомплекстүзеді. КомплекстіқысқашаФ + С (фермент+ + субстрат) депбелгілейді. Бұлкомплекстіңтүзілуінеәлдеқайдаазмөлшердегіэнергияқажет.
Фермент + субстрат аралықкомплексінтүзукезінде субстрат молекулаларыбіраздеформацияғаұшырайды, сондықтанреакцияның активация энергиясыкемиді. Бұл деформация субстраттың молекула ішілікбайланыстарынәлсіретедіжәнемолекуланыбелгілібірреакцияғанеғұрлымқабілеттіетіпшығарады. Комплекстіңтүзілуіспектрлікметодтардыңжәрдемімендәлелденген.
Ф+С аралықкомплексінтүзуде субстрат ферменттіңбүкіл молекуласымен емес, оныдактивтікорталықтардеп аталатынжекелегең учаскелерімен қосылады. Ферменттіңәрбір молекуласында 1—2 активтікорталық бар екендігіанықталып отыр.
Активтік орталықтықкеңістіктік құрылысы мен химиялықтабиғатыбелгілі бір субстратқағанасай келетіндейболып қалыптасқан. Бұл фермент басқа субстратқа катализатор бола алмайды. Осы ерекшелік ферменттердің талдаушылық қасиетінбелгілейді.
Органикалықзаттар мен ферменттердің структурасынзерттей келе, Э.. Фишер фермент пен субстраттың кедістіктіксәйкестігініңжақындығыженіндеқорытындышығарып, фермент субстратқақұлпыныңкілтіндейсәйкескеледідепсипаттады.
Ферменттердің белсенділгі,ферменттік реаксиялардың күшейткіштері (активаторлар) мен тежегіштер (ингивиторлар) тежегіштіктің тиіптпрін түсіндіріңіз,бәсекелестік, бәсекелестік емес,бәсекелессіз.
Фермент активтілігі ортада əртүрлі химиялық реакциялардың болуына байланысты. Ондай заттардың кейбіреуі фермент активтілігін арттырады, мұндай қосылыстар активаторлар деп аталады. Ал екінші бір заттар фермент əрекетін баяулатады, тіптіоны тежейді. Мұндай заттар ингибиторлар (тежегіштер) деп аталады.Активаторлар ферменттік реакцияларды тездетеді. Мысалы, қарын сөлінде тұз қышқылы пепсинді активтендіреді, сөйтіп белок гидролизі тездейді. Ұлпаларда кездесетін кейбір ферментерді (оксидоредуктазаларды, катепсиндерді) құрамында бос сульфгидрильдік топтары бар қосылыстар (глутатион, цистеин) активтендіреді.
Ингибиторлар ферменттік реакцияларды тежейді. Мысалы, инсектицидтер холинэстераза ферментінің əсерін тежейді, ол ферменттің активті орталығымен байланысады да, жүйке жүйесін тырыстырып істен шығарады, парализдейді.Бір ферментке активатор ретінде əсер ететін, ал екіншісі ферментке ингибитор ретінде əсер ететін заттар да бар. Мысалы, тыныс алу жүйесіндегі цианидтер цитохромоксидаза ферментінің əрекетін тияды, ал папаин, каталаза ферменттерінің активтілігін арттырады.
Проферменттер (латын тілінде pro –алдыңғы, бұрынғы жəне фермент деген сөзден шыққан) – ферменттердің активті емес түрі. Безді эпителийде бірқатар протеолиттік ферменттер активті емес күйде – проферменттер түрінде синтезделеді. Мысалы, пеп-син қарынның ішкі қабатында пепсиноген проферменті түрінде түзіледі, трипсин ұйқы безінде трипсиноген түрінде түзіледі Осының арқасында проферменттер түзілген жасушалар мен ұлпалар өздерін өздері бүлдіріп бұзбайды. Проферменттердің активті түрге (ферментке) айналуын физиологиялық жəне биохимиялық жағдайлар реттейді. Проферменттің активтену процесі былай болады: пептидтік байланысты үзу арқылы профермент молекуласынан бір пептид немесе бірнеше пептид бөлініп ажырайды, осының нəтижесінде ферменттің керекті конформациясы қалыптасады жəне оныңактивті орталығы ашылады. Активсіз түрден активті түрге айналу механизмі əртүрлі. Активті топтары парализатормен (ингибитор) байланысқан кейбір ферменттер, сол тобы ыдырағанда активті түрге айналады. Мысалы, активсіз пепсиноген немесе трипсиноген, полипептидті табиғаты бар ингибитордан бөлінгенде, активті
пепсин мен трипсинге айналады. Трипсиноген, химотрипсиноген ұйқы безінде синтезделеді де, он екі елі ішекке барады, сол жерде екеуі активтенеді. Бұл кездетрипсиногеннің N- соңынан гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз) ажырап бөлінеді жəне трипсин ферменті пайда болады.
Изофермент дегеніміз – (грек тілінен аударғанда isos – тең, бірдей және фермент деген сөзден шыққан) — бір ферменттің әр түрі, олардың полипептидтік құрылысында бір-бірінен айырмашылықтары, өзгешеліктерінің болуы. Олар бір түрге жататындардың ағзасында немесе жеке клеткасында кездеседі, олардың катализдік активтілігі әр түрлі болады. Изоферменттер немесе изоэнзимдар — бұл ферменттiң бiр реакциясын катализдейтiн көптiк формалары, бiрақ субстратқа, катализделетiн (белсендiлiк) реакцияның максимал жылдамдығына, электрофоретиялық қуаттылығына немесе реттегіш қасиеттерінің жақындығына,жеке алғанда физикалық және химиялық қасиеттері бойынша бiр-бiрiмен айырмашылығы болады.






