Возникший в процессах обмена веществ аммиак и безазотистый остаток аминокислот претерпевают своеобразные превращения. Основной путь нейтрализации и связывания аммиака у уреотелических животных заключается в синтезе мочевины, протекающем в печени и состоящем из серии последовательных ферментативных реакций. Первый этап этого процесса заключается в образовании карбамилфосфата (так же, как при синтезе пиримидиновых оснований), затем карбамильная группа акцептируется орнитином.
Образовавшийся при этом цитруллин эндергонически реагирует с аспарагиновой к-той. Образовавшаяся аргининянтарная к-та подвергается расщеплению: один из продуктов реакции — фумаровая к-та — включается в цикл трикарбоновых кислот, другой — аргинин — гидролитически расщепляется аргиназой на мочевину и орнитин (рис. 5). Последний вновь включается в цепь превращений, приводящих к образованию мочевины. Процесс этот, получивший наименование орнитинового цикла, протекает в печени, хотя отдельные его реакции представлены также в сердце, ткани мозга и др.

Рис. 5. Орнитиновый цикл
Т. о., азот, выводимый из организма в виде мочевины, наполовину берется из аммиака и наполовину из аспарагиновой к-ты.
Нейтрализация образующегося в организме аммиака происходит еще путем синтеза амидов — аспарагина и глутамина. Амидная группа последнего участвует в синтезе пуринов, нуклеиновых кислот и т. д.
Нейтрализация аммиака у урикотелических животных (рептилии, птицы) связана с образованием мочевой кислоты (см.).
Безазотистая часть аминокислот, как правило, включается через многочисленные промежуточные этапы в разные стадии окислительных превращений по циклу трикарбоновых кислот (см. Трикарбоновых кислот цикл).
Согласно схеме, приведенной на рис. 6, отчетливо выявляется роль аминокислот в обеспечении энергетических запросов организма. Нарушения в превращениях тех или иных аминокислот часто генетически обусловлены и являются причиной различных болезней.
Причиной нарушений, как правило, является дефект в одном специфически действующем ферменте или в серии ферментативных реакций. Эти нарушения могут возникнуть, напр., в силу недостаточного образования или слишком быстрого расщепления кофермента, участвующего во многих ферментативных процессах.
Тканевой обмен нуклеотидов
Продукты распада нуклеопротеидов и нуклеиновых кислот — нуклеотиды и нуклеозиды — претерпевают в органах п тканях различные превращения.
Синтез ДНК и РНК
Нуклеотиды — как пуриновые, так и пиримидиновые — участвуют в синтезе нуклеиновых кислот в клеточных ядрах. Синтез ДНК осуществляется ферментами — ДНК-полимеразами, для которых субстратами служат дезоксирибонуклеозидтрифосфаты.
Синтез ДНК сопровождается освобождением молекул пирофосфата в количестве, соответствующем числу молекул нуклеозидтрифосфатов, вступивших в реакцию. ДНК (образец) и вновь синтезированный полинуклеотид образуют вместе двутяжную ДНК. Схема этого процесса может быть представлена в следующем виде:
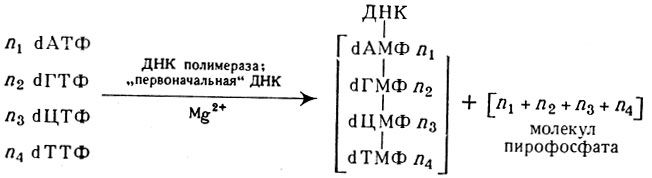
Схема биосинтеза ДНК
Буква «d» перед символом нуклео-зидтрифосфата или мононуклеотидов в синтезированной молекуле ДНК обозначает, что в биосинтезе участвуют нуклеотиды, в к-рых пентоза представлена дезоксирибозой, т. е. дезоксирибонуклеотиды. Образование дезоксирибонуклеотидов происходит в результате сложного процесса восстановления рибонуклеотидов при действии нечувствительного к нагреванию белка — тиоредоксина.
Восстановленная форма тиоредоксина образуется под действием редуктазы (фермента флавопротешговой природы), коферментом к-рого служит восстановленный никотинамидадениндпнуклеотидфосфат (НАДФ) по схеме:

Образовавшаяся восстановленная форма тпоредоксина участвует в образовании дезоксинуклеотиддифосфатов (дНДФ) путем переноса редуцирующих эквивалентов на акцептирующие пх нуклеотиддифосфаты (НДФ):

Вновь образованная ДНК и служившая шаблоном ДНК могут на своих концах соединиться под влиянием фермента ДНК-лигазы и образовать циклическую структуру ДНК.
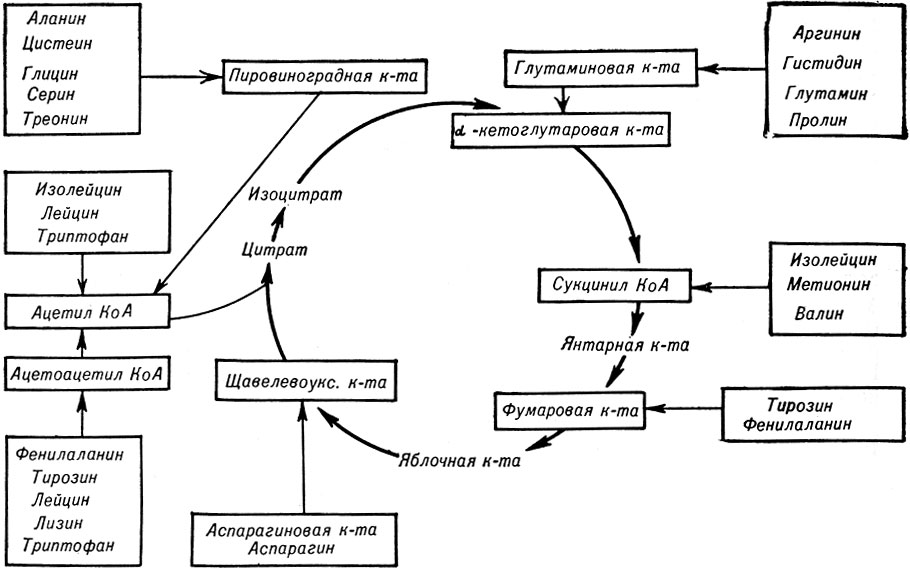
Рис. 6. Цикл трикарбоновых кислот (по Ленинжеру)
Синтез РНК осуществляется при участии полинуклеотидфосфорилазы — фермента, обусловливающего обратимую реакцию соединения нуклеозидднфосфатов в присутствии ионов магния и первоначальной РНК:

Схема биосинтеза РНК
Образованный полимер содержит 3 ′-5 ′-фосфодиэфирные связи, к-рые расщепляются рибонуклеазой. Реакция обратима и может быть направлена справа налево (в сторону распада полимера) при увеличении концентрации неорганического фосфата. Первоначальная РНК в данном случае не играет роли шаблона, по к-рому синтезируется полинуклеотид. Скорее всего свободная ОН-группа, находящаяся в концевом нуклеотиде РНК, необходима для присоединения к ней последующих нуклеотидов независимо от входящих в их состав оснований.
По-видимому, в интактной клетке полинуклеотидфосфорилазе принадлежит функция не образования полимера, а расщепления РНК. Что касается высокополимерной РНК с определенной последовательностью нуклеотидов, то образование ее осуществляется РНК-полимеразой, действие к-рой аналогично ферменту, синтезирующему ДНК. РНК-полимераза активна в присутствии ДНК-шаблона, осуществляет синтез РНК из нуклеозидтрифосфатов и собирает их в последовательности, предопределенной структурой ДНК:
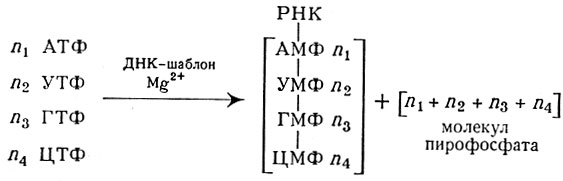
Схема синтеза полимерной РНК
Катаболизм ДНК и РНК
Деградация ДНК и РНК происходит по этапам. Ферменты, расщепляющие РНК, — рибонуклеазы — широко представлены в различных животных тканях. Под влиянием рибонуклеаз двоякого типа — трансфераз и истинных гпдролаз — из РНК образуются олиго- и мононуклеотиды.
Ферменты, расщепляющие ДНК, принадлежат к нуклеазам — гидролазам; результатом их действия является образование олигонуклеотидов как с концевым 5′-фосфатом, так и 5′-фосфатом. Под влиянием диэстераз, специфических нуклеотидаз, фосфорилаз, фосфатаз и нуклеозидаз происходит деградация нуклеотидов с образованием свободных пуриновых и пиримндиновых оснований, дальнейшее превращение к-рых идет по разным путям.
Пуриновые основания — аденин и гуанин — подвергаются гидролитическому дезаминированию под влиянием ферментов аденазы и гуаназы. Из аденина образуется 6-оксипурин (гипоксантин), из гуанина — 2,6-диоксипурин (ксантин). Эти превращения ампнопуринов могут происходить и без предварительного распада соответствующих нуклеотидов и нуклеозидов. Гипоксантин и ксантин подвергаются дальнейшему окислению под влиянием фермента ксантиноксидазы. Конечным продуктом этого окисления является 2, 6, 8-триоксипурин, или мочевая кислота (см.). У человека мочевая к-та дальнейшим превращениям не подвергается и является постоянной составной частью мочи п конечным продуктом обмена пуриновых нуклеотидов и пу-риновых оснований. У большинства млекопитающих мочевая к-та не представляет собой конечного продукта обмена веществ и переходит в аллантоин под действием фермента уриказы.

Рис. 7. Схема распада (деградации) пуриновых оснований
Стадии дезаминирования и окисления пуриновых оснований представлены на рис. 7.
По иному пути идет деградация пиримидиновых оснований (см.). Первый шаг заключается в восстановлении урацила в дигидроурацил с последующим гидролизом, приводящим к образованию сначала β-уреидопропионовой к-ты, а затем β-аланина, NH3 и СО2 (рис.8):
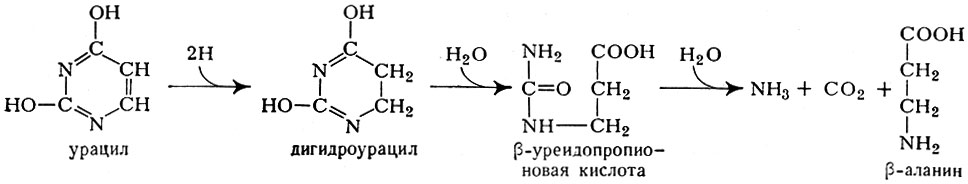
Рис. 8. Схема распада (деградации) пиримидиновых оснований
Аналогичные превращения тимина приводят к образованию β-аминоизо-масляной к-ты.
Т. о., конечным продуктом обмена пуринов у человека является мочевая к-та, а пиримидинов — углекислый газ и аммиак, к-рые могут быть источниками образования мочевины. Что касается (β-аланина, то эта аминокислота участвует в биосинтезе дипептидов карнозина (см.) и ансерина (см.), в большом количестве содержащихся в скелетной мускулатуре позвоночных животных.

В мышечной ткани человека содержится лишь карнозин.
β-аланин является также составной частью пантотеновой к-ты, а следовательно, и коэнзима А, играющего очень важную роль в обмене жирных кислот, стеринов, а также в цикле трикарбоновых кислот.






