
Схема 10.3. Работа в эпидемическом очаге гриппа и других острых респираторных заболеваний

В РФ организована система эпидемиологического надзора за гриппом, осуществляющая плановый мониторинг за состоянием здоровья людей, и за циркуляцией вируса гриппа, предусматривающий проведение исследований на территориальном, региональном и центральном уровнях.
В рамках эпидемиологического надзора анализируют заболеваемость гриппом и острыми респираторными вирусными инфекциями, проводят молекулярно-генетические исследования выделенных штаммов гриппа, оценивают уровень охвата населения вакцинацией против гриппа.
Дифтерия
Дифтерия - антропонозная бактериальная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется общей интоксикацией, преимущественным поражением слизистых оболочек ротоглотки и дыхательных путей с развитием фиброзного воспаления в месте внедрения возбудителя, и токсическим поражением сердечно-сосудистой системы, нервной системы и почек.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и пути передачи возбудителя.
4. Проявления эпидемического процесса дифтерии.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - токсигенные коринебактерии Corynebacterium diphtheriae рода Corynebacterium (палочка Клебса-Леффлера) - грамположительные неподвижные палочки с булавовидными утолщениями на концах. По культуральным, морфологическим и ферментативным свойствам различают 4 биотипа: gravis, intermedius, mitis, belfanti. Среди них существуют токсигенные и нетоксигенные штаммы. Наиболее распространенны биотипы mitis и gravis.
В серологическом отношении коринебактерии дифтерии разделяют на более чем 50 сероваров. Наибольшего антигенного разнообразия (до 40 сероваров) достигает биотип mitis.
Фаготипирование коринебактерий дифтерии применяют в эпидемиологической практике при обследовании очагов и расшифровке групповых заболеваний.
Коринебактерии дифтерии имеют сложную антигенную структуру. Основным признаком патогенности дифтерийных бактерий является способность вырабатывать экзотоксин, вирулентность определяется адгезией, т.е. способностью прикрепляться к слизистым оболочкам (или коже).
Палочки Клебса-Леффлера обладают значительной устойчивостью во внешней среде. В пыли сохраняются до 2 мес, в дифтерийной пленке, капельках слюны, на инфицированных предметах домашнего обихода они могут сохраняться в течение 2 нед, в воде и молоке - 6-20 дней, в трупе - около 2 нед; устойчивы к замораживанию. Прямые солнечные лучи, высокая температура и дезинфицирующие растворы для них губительны.
Источник возбудителя инфекции - человек, больной или носитель токсигенных коринебактерий. По массивности выделения возбудителя ведущее место в качестве источника инфекции занимают больные дифтерией. Однако наибольшее эпидемиологическое значение среди них имеют больные атипичными клиническими формами дифтерии, поскольку последних часто не диагностируют или выявляют в поздние сроки. Больные выделяют возбудителя дифтерии в течение всего заболевания, а также в период реконвалесценции. Длительность носительства у реконвалесцентов составляет 2-7 нед, редко - до 3 мес.
Существенное эпидемиологическое значение как источник возбудителя дифтерии имеют бактерионосители, которым принадлежит ведущая роль в распространении инфекции в условиях спорадической заболеваемости. Бактериологические наблюдения показали, что при острых воспалительных изменениях в рото- и носоглотке обнаруживается более высокая обсемененность слизистых оболочек коринебактериями дифтерии. Установлено, что большую опасность заражения окружающей среды создают бактерионосители, выделяющие коринебактерии дифтерии из носа. Кроме того, эпидемиологическая опасность бактерионосителей зависит от длительности выделения возбудителя. Различают 4 категории носительства: 1-7 дней - транзиторное; 7-15 дней - кратковременное; 15-30 дней - средней продолжительности; более 1 мес - затяжное. С увеличением продолжительности носительства возрастает опасность для окружающих лиц. Частота длительного носительства неодинакова в разных коллективах и может составлять до 13-29% от общего числа всех носителей.
При отсутствии регистрируемой заболеваемости дифтерией бактерионосители имеют большое значение как резервуар инфекции, сохраняя непрерывность эпидемического процесса.
Механизм передачи возбудителя - аспирационный. Ведущий (главный) путь передачи - воздушно-капельный, фактор передачи - воздух, в котором взвешен бактериальный аэрозоль.
Коринебактерии достаточно устойчивы вне организма. В связи с этим возможен воздушно-пылевой путь, а также бытовой и пищевой (редко) пути передачи возбудителя. Имеются описания пищевых и молочных вспышек дифтерии.
Восприимчивость к дифтерии определяется состоянием антитоксического и антимикробного иммунитета.
Эпидемический процесс дифтерии развивается в условиях плановой вакцинопрофилактики, что внесло определенные изменения в его проявления (рис. 10.2).
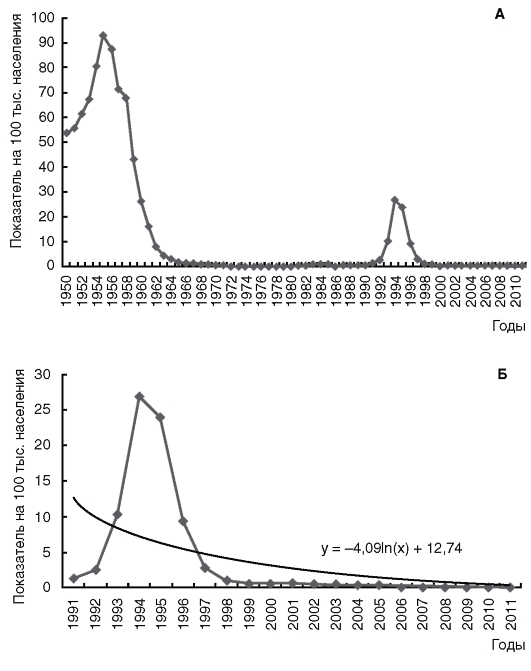
Рис. 10.2. Многолетняя динамика заболеваемости дифтерией на территории Российской Федерации: А - в 1950-2010 гг.; Б - 1991-2011 гг.
В 60-70-е годы ХХ в. не регистрировали периодических подъемов заболеваемости, столь характерных для допрививочного периода; произошло сглаживание осенне-зимней сезонности; основной формой инфекционного процесса стало носительство токсигенных бактерий у иммунных лиц. В целом по РФ в результате создания высокой иммунной прослойки среди населения заболеваемость снизилась до спорадического уровня; манифестные формы болезни были редкими, а носительство сохранилось повсеместно, но уровень его был низким. На этом фоне в конце 70-х годов началась активизация эпидемического процесса, охватывая главным образом взрослое население. К середине 90-х годов был зарегистрирован эпидемический подъем заболеваемости.
В эти годы взрослые составляли 82,2-89,1% от всего количества больных дифтерией, в то время как в 1958 г., например, их доля была 19%. «Повзросление» дифтерии в конце 70-х - начале 80-х годов произошло вследствие низкого уровня поствакцинального антитоксического иммунитета у взрослых. Основной причиной этого явления были серьезные недостатки в организации и проведении прививок населению и как следствие этого низкий уровень коллективного иммунитета. Распространению дифтерии способствовала также смена доминирующего биовара возбудителя - вместо биовара mitis стал широко циркулировать биовар gravis, характеризующийся более высокой вирулентностью и патогенностью.
В результате этого произошло накопление большой массы неиммунных взрослых и детей, эпидемический процесс дифтерии активизировался, приобретя характер эпидемической заболеваемости, поскольку известно, что уровень заболеваемости обратно пропорционален уровню привитости населения против этой инфекции.
Принимая во внимание сложившуюся эпидемиологическую ситуацию по дифтерии в целом, в стране была проведена массовая вакцинация взрослого населения по эпидпоказаниям в 90-е годы ХХ в., что переломило ход эпидемии, и с 1995 г. уровень заболеваемости стал неуклонно снижаться (рис. 10.3).

Рис. 10.3. Заболеваемость дифтерией и уровень охвата прививками в возрасте 12 мес
В 2005-2011 гг. на фоне устойчиво высоких уровней охвата прививками против дифтерии детей и взрослых отмечается спорадическая заболеваемость с показателем, не превышающим 0,01 на 100 тыс. населения, что свидетельствует о том, что многолетняя плановая иммунизация населения обеспечила надежную и длительную специфическую защиту от этой инфекции.
В условиях низкой заболеваемости дифтерией основное значение в плане осуществления эпидемиологического надзора имеет слежение за уровнем охвата прививками населения и состоянием коллективного антитоксического противодифтерийного иммунитета.
Профилактические и противоэпидемические мероприятия. Основная роль в профилактике дифтерии принадлежит плановой вакцинации, проводимой согласно Национальному календарю профилактических прививок.
В комплексе противоэпидемических мер особое значение принадлежит раннему и активному выявлению больных (схема 10.4).
Схема 10.4. Работа в эпидемическом очаге дифтерии Направленность и содержание противоэпидемических мероприятий

Больных дифтерией или при подозрении на дифтерию госпитализируют немедленно. Провизорной госпитализации подлежат больные ангиной с наложениями или крупом из эпидемического очага дифтерии. Для раннего выявления дифтерии, помимо немедленного бактериологического обследования больных ангинами, необходимо активное наблюдение их в течение 3 дней. В инфекционное отделение госпитализируют носителей токсигенных коринебактерий. Врач, установивший диагноз, немедленно отправляет экстренное извещение в территориальный отдел Роспотребнадзора. В этот же день эпидемиолог начинает в очаге эпидемиологическое обследование, задачи которого - выявление источника инфекции, определение границ очага, организация в нем противоэпидемической работы. Бактериологическое обследование контактных проводят однократно, одномоментно. Мазки из носа и с миндалин, взятые сухим стерильным тампоном натощак или через 2 ч после еды, немедленно отправляют в лабораторию. Через 24 ч при необходимости может быть выдан предварительный ответ на обнаружение коринебактерий дифтерии; через 48 ч - ответ о наличии токсигенных коринебактерий; через 72 ч -подтверждение о выделении токсигенных или нетоксигенных коринебактерий. Через 96 ч лаборатория выдает ответ о биохимических свойствах токсигенных и нетоксигенных культур. Медицинское наблюдение продолжают 7 дней, в первые 3 дня общавшихся с больным также осматривает оториноларинголог. Содержание последующей работы зависит от результатов обследований. Выявленных больных и носителей токсигенных коринебактерий госпитализируют. Только в некоторых случаях в школах-интернатах и детских домах с численностью детей не более 300 при условии полностью привитого коллектива и обнаружении более 10% носителей токсигенных коринебактерий разрешается оставить носителей в коллективе при постоянном медицинском наблюдении и бактериологическом обследовании.
Носителей нетоксигенных коринебактерий дифтерии не лечат антибиотиками и не госпитализируют, для них обязательна консультация оториноларинголога, выявление и лечение патологических процессов в носоглотке.
Важным разделом противоэпидемической работы в очаге является создание противодифтерийного иммунитета у контактных лиц, или вакцинация по эпидемическим показаниям. Для этого АДС-М вводят однократно в дозе 0,5 мл детям и взрослым, у которых наступил срок ревакцинации, а также лицам, не получавшим ранее прививок и не имеющим противопоказаний.
Существуют 3 группы показаний для бактериологического обследования на носительство возбудителя дифтерии: диагностические, эпидемиологические и профилактические (схема 10.5).
Схема 10.5. Показания для бактериологического обследования на носительство возбудителя дифтерии

По предложению ВОЗ используют следующие количественные критерии, характеризующие степень восприимчивости к дифтерии в зависимости от уровня антитоксических антител (табл. 10.1).
Таблица 10.1. Уровень противодифтерийных антитоксических антител и восприимчивость к дифтерии
| Содержание антитоксических антител | Интерпретация результатов |
| <0,01 МЕ/мл | Обследуемый восприимчив к дифтерии |
| 0,01 МЕ/мл | Минимальный уровень циркулирующих антител, обеспечивающий некоторуюстепень защиты |
| 0,01-0,09 МЕ/мл | Уровни циркулирующих антитоксических антител, обеспечивающий некоторуюстепень защиты |
| 0,1 МЕ/мл | Защитныйуровень циркулирующих антител |
| >1,0 МЕ/мл | Уровень антитоксина, обеспечивающий стойкую длительнуюневосприимчивость к дифтерии |
Эпидемиологическое благополучие территории в отношении дифтерии характеризуют следующие критерии:
• охват профилактическими прививками против дифтерии детей и взрослых в декретированном возрасте не менее 95%;
• регистрация единичных случаев дифтерии, не сопряженных с риском летального исхода;
• отсутствие клинически диагностируемых гипертоксических форм дифтерии;
• отсутствие летальных исходов дифтерии в течение последних 5 лет;
• отсутствие эпидемических очагов дифтерии с вторичными случаями заболевания.
Корь
Корь - антропонозная вирусная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется лихорадкой, интоксикацией, этапным высыпанием пятнисто-папулезной сыпи, энантемой, катаральными явлениями со стороны конъюнктивы, носоглотки и верхних дыхательных путей.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и пути передачи возбудителя.
4. Эпидемический процесс кори.
5. Профилактические и противоэпидемические мероприятия.
В эпидемиологической характеристике кори, как и других болезней, управляемых средствами иммунопрофилактики, выделяют допрививочный период и период плановой вакцинопрофилактики.
Живая коревая вакцина, введенная в Календарь профилактических прививок детей в России с 1968 г., признана основным средством предупреждения болезни. В последовавшие затем годы заболеваемость корью и возрастной состав болевших находились в прямой зависимости от удельного веса защищенных от кори за счет формирования поствакцинального иммунитета.
Повсеместное и неуклонное повышение охвата вакцинацией и ревакцинацией в установленные Национальным календарем сроки, наличие в стране высокоэффективной живой коревой вакцины позволили разработать Национальную программу ликвидации кори и включиться в программу Европейского регионального бюро ВОЗ по элиминации этой инфекции.
В рамках реализации Программы ликвидации кори в РФ поставлена задача достижения уровня заболеваемости менее 1 случая на 1 млн населения (менее 0,1 на 100 тыс. населения), что позволит начать процедуру сертификации территории, как свободной от эндемичной заболеваемости корью.
Возбудитель - РНК-содержащий вирус семейства Paramyxoviridae рода Morbillivirus, неустойчив во внешней среде, высокочувствителен к высыханию и дезинфицирующим веществам. Для вируса кори характерны высокая контагиозность (индекс контагиозности приближается к единице), антигенная стабильность; серотипы вируса не обнаружены.
Описано 22 генотипа вируса кори, объединенных в 8 групп. До 2007 г. на территории РФ циркулировал эндемичный штамм вируса кори генотипа D6. Штаммы других генотипов выделялись крайне редко и имели ограниченное распространение. В дальнейшем, на фоне значительного снижения заболеваемости, произошло изменение циркулирующих генотипов вируса, были изолированы штаммы генотипов Н1, D4, D5, D8, D9, импортированные из эндемичных по кори регионов земного шара.
Источник возбудителя инфекции -только больной корью с достаточно точно очерченным заразным периодом: последний день инкубационного периода, продромальный период, первые 5 дней периода высыпаний.
При осложнениях, которыми может сопровождаться болезнь, возможно удлинение заразного периода до 10-го дня от появления сыпи. Знание срока начала и окончания заразного периода у больного имеет исключительное значение для выявления заразившихся из числа общавшихся с больным и определения границ эпидемического очага. Поэтому при обнаружении больного и отправлении экстренного извещения о нем в территориальный отдел Роспотребнадзора лечащий врач должен указать дату появления сыпи. Инкубационный период кори продолжается 9-21 день. Для наступающего затем продромального периода (3-4 дня) характерны катаральные явления, конъюнктивит, температурная реакция. Неспецифичность этих признаков затрудняет диагностику. И только поражение слизистой оболочки ротовой полости (пятна Филатова-Коплика) имеют существенное диагностическое значение.
В условиях массовой вакцинопрофилактики диагностика кори затруднена из-за большой частоты легкого и атипичного течения болезни у ранее привитых.
Действующие в РФ санитарные правила «Профилактика кори, краснухи, эпидемического паротита» включают сформулированные ВОЗ критерии «стандартного определения случая кори» (табл. 10.2).
Таблица 10.2. Критерии определения случая кори (СП 3.1.2952-11)
| Определение | Клинические критерии |
| Стандартный случай кори | Совокупность клинических проявлений: • кашель и (или) насморк, конъюнктивит; • общая интоксикация, температура тела 38 °С и выше; • поэтапное высыпание пятнисто-папулезной сливной сыпи с 4-5-го дня болезни (1-й день - лицо, шея; 2-й день - туловище, 3-й день - ноги, руки) и пигментация |
| «Подозрительный» случай | Острое заболевание, при котором имеется один или несколько типичных клинических признаков кори |
| «Вероятный» случай | Острое заболевание, при котором имеются клинические признаки кори и эпидемиологическая связь с другим подозрительным или подтвержденным случаем данной болезни |
| «Подтвержденный» случай | Заболевание, классифицированное как «подозрительный» или «вероятный» случай кори после лабораторного подтвержденного диагноза |
Окончательный диагноз кори устанавливают на основании клинических данных, лабораторного подтверждения и (или) наличия эпидемиологической связи с другими лабораторно подтвержденными случаями кори.
Больного, у которого на основании клинической картины подозревают корь, обследуют с использованием серологического (ИФА) и молекулярно-генетического (ПЦР) методов исследования. Взятие крови для серологического исследования проводят на 4-5-е сутки с момента появления сыпи и через 10-14 дней от даты отбора первой пробы. Сыворотки крови направляют в лабораторию Регионального центра по надзору за корью и краснухой. Диагноз кори подтверждает обнаружение противокоревых IgM антител в первой пробе сыворотки крови, а также нарастание уровня IgG антител в 4 раза и более при одновременном исследовании парных сывороток.
Отбор клинического материала (моча, носоглоточные смывы) для исследования ПЦР проводят на 1-3-е сутки с момента появления сыпи. Положительный результат позволяет не только подтвердить диагноз кори, но и определить генотип вируса.
Все случаи кори подлежат регистрации в электронной Единой международной системе индивидуального учета (CISID - англ. Centralized information system for infectious diseases), которую осуществляют Региональный центр и Национальный научно-методический центр по надзору за корью и краснухой РФ.
Механизм передачи возбудителя - аспирационный; путь передачи - воздушно-капельный.
Вирус кори, находясь в слизистой оболочке верхних дыхательных путей и в носоглоточной слизи, выделяется из организма при кашле, чиханье, разговоре и даже дыхании в форме мельчайших капелек аэрозоля. Вирус крайне не стоек во внешней среде, поэтому распространение его происходит только воздушно-капельным путем, как правило, на расстоянии около 2 м в пределах закрытого помещения. Однако при благоприятных условиях высокодисперсный аэрозоль, содержащий вирус кори, может распространяться с потоками воздуха на значительные расстояния. Высокая чувствительность восприимчивых к кори людей при легком воздушно-капельном пути передачи приводит к заражению даже при кратковременности общения с больным.
В случае заболевания корью беременной может реализоваться трансплацентарный путь передачи.
Восприимчивость к кори чрезвычайно высокая. Обычно заболевают все неиммунные, общавшиеся с больным. Постинфекционный иммунитет, как правило, пожизненный. В современный период восприимчивость детского населения к кори зависит от уровня охвата плановыми прививками. Новорожденные, матери которых имеют постинфекционный или поствакцинальный иммунитет, защищены от заболевания.
Эпидемический процесс. Корь распространена повсеместно. Проявления эпидемического процесса кори определяются уровнем коллективного иммунитета.
Многолетняя динамика заболеваемости корью и полнота охвата детей прививками приведена на рис. 10.4, 10.5.
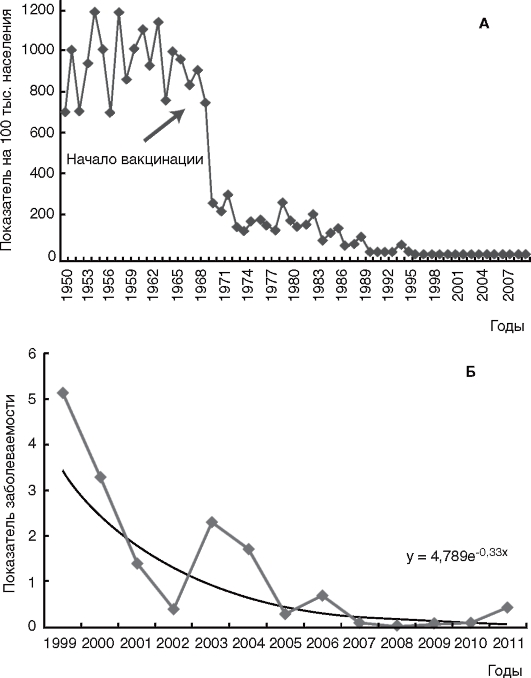
Рис. 10.4. Многолетняя динамика заболеваемости корью на территории Российской Федерации: А - в 1950-2007 гг.; Б - 1999-2011 гг.

Рис. 10.5. Заболеваемость корью и уровень охвата прививками в возрасте 24 мес
Характерное для кори чередование периодических подъемов и снижения заболеваемости сохраняется, однако если до начала плановой вакцинопрофилактики периодические подъемы заболеваемости регистрировали повсеместно с интервалом в 2-3 года, то на фоне вакцинопрофилактики этот интервал удлинился до 8-10 лет.
Современные проявления эпидемического процесса кори: спорадическая заболеваемость (возможны вспышки среди непривитых), смещение сезонного подъема заболеваемости на весенние и летние месяцы, изменение возрастной структуры заболевших. Основным контингентом, определяющим заболеваемость корью, является взрослое население, среди которого имеются восприимчивые к данной инфекции. Большинство детей, заболевающих корью, не имеют прививок. Возможно также заболевание корью привитых, что связывают с индивидуальными особенностями, а также с дефектами в организации прививочной работы, в частности с нарушением принципа «холодовой цепи».
В 2010 г. в рамках стратегического плана Европейского региона ВОЗ («Программа ликвидации кори в Российской Федерации») была начата процедура сертификации для подтверждения территорий, свободных от эндемичной кори. Показатель заболеваемости корью в целом по стране не превысил критерия элиминации кори (1 случай на 1 млн населения).
Однако в стране были зарегистрированы завозные случаи кори, что осложнило эпидемиологическую ситуацию. От заболевших были выделены штаммы вирусов кори с генотипами, которые в РФ ранее не циркулировали (Н1, D4, D5, D8, D9 и B3) и были преимущественно импортированы из эндемичных по кори регионов земного шара (Китай, Индия, Индонезия, Таиланд, Западная Африка). При этом длительность циркуляции завозных штаммов на территории РФ не превышала 3 мес.
Данные филогенетического анализа выделенных штаммов вируса кори подтвердили их завозной характер и различие источников инфекции. Прерывание циркуляции ранее эндемичного генотипа D6 в течение 2007-2010 гг. и отсутствие продолжительной (более 6 мес) местной циркуляции импортированных генотипов вируса свидетельствуют о стабилизации фазы элиминации кори на территории РФ.
Успехи, достигнутые в борьбе с корью, позволяют сделать вывод, что эндемичная корь элиминирована в РФ, большинство субъектов страны готово к подтверждению статуса территорий, свободных от эндемичной кори.
Профилактические и противоэпидемические мероприятия. Организация противоэпидемической работы в очаге кори приведена на схеме 10.6.
Схема 10.6. Работа в эпидемическом очаге кори. Направленность и содержание противоэпидемических мероприятий

Изоляция больного, находящегося в заразном периоде, обязательна, госпитализация - избирательная. Клиническими показаниями для госпитализации, заболевших корью, служат тяжелые формы болезни, наличие осложнений и серьезных сопутствующих заболеваний. По эпидемическим показаниям госпитализируют больных, проживающих в неблагоприятных бытовых условиях, из детских учреждений с круглосуточным пребыванием детей, из общежитий, а также при наличии в семье заболевшего людей из числа декретированных групп населения. Госпитализированные больные должны находиться в стационаре до исчезновения клинических симптомов, но не менее 5 дней с момента появления сыпи.
Нестойкость вируса кори во внешней среде делает ненужной дезинфекцию, поэтому в очаге достаточно проветривания и обычной уборки.
Эпидемиолог, проводя эпидемиологическое обследование очага при выявлении первого больного корью, с предельной тщательностью обязан определить границы очага и выявить восприимчивых, которые нуждаются в защите. Инкубационный период кори достаточно продолжителен, поэтому возможны ситуации, когда общавшийся с больным восприимчивый человек может оказаться в каком-либо стационаре по поводу другого заболевания. В этом случае только своевременная информация эпидемиолога может предотвратить занос инфекции в стационар и ее внутрибольничное распространение. Людей, контактировавших с больным корью, не допускают к плановой госпитализации в
медицинские организации неинфекционного профиля и социальные организации в течение всего периода медицинского наблюдения.
Наибольший риск заболеть корью имеют ранее не болевшие и не привитые, поэтому в эпидемическом очаге кори не позднее 72 ч с момента выявления больного проводят вакцинацию живой коревой вакциной не болевших корью, не привитых и не имеющих сведений о прививках при отсутствии у них противопоказаний. Вакцинируют также однократно привитых людей. Прививки по эпидемическим показаниям в очаге кори проводят без ограничения возраста.
Детям, имеющим медицинские отводы от профилактических прививок или не достигшим прививочного возраста (12 мес), не позднее 5-го дня с момента контакта с больным корью вводят иммуноглобулин человека нормальный или противокоревой.
За людьми, общавшимися с больным и не болевшими корью, устанавливают медицинское наблюдение в течение 21 дня. Если очаг инфекции зарегистрирован в детском дошкольном учреждении или школе, то с момента выявления первого больного до 21-го дня с момента выявления последнего заболевшего в детские коллективы принимают только ранее переболевших и привитых живой коревой вакциной.
Детей и взрослых, переболевших корью, принимают в коллектив после полного клинического выздоровления, но не ранее 10-го дня от начала болезни.
Основным методом профилактики кори признана плановая вакцинопрофилактика, которую осуществляют в рамках Национального календаря профилактических прививок с охватом не менее 95% декретированных возрастных групп. Вакцинацию живой коревой вакциной (моновакциной или поликомпонентными препаратами) проводят однократно в возрасте 12 мес с последующей ревакцинацией в 6 лет. Дети в возрасте 15-17 лет включительно и взрослые в возрасте до 35 лет, не привитые ранее или не имеющие сведений о прививках против кори, подлежат двукратной иммунизации с интервалом не менее 3 мес. Подростки и взрослые, привитые однократно, должны быть ревакцинированы.
Коклюш
Коклюш - антропонозная бактериальная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется приступами спазматического кашля, интоксикацией и преимущественным поражением дыхательных путей.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и пути передачи возбудителя.
4. Эпидемический процесс коклюша.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - Bordetellapertussis рода Bordetella (палочка Борде-Жангу). Это бактерии, малоустойчивые в окружающей среде. Циркулирующие возбудители различаются по набору типовых антигенов: 1, 2, 3; 1, 2, 0; 1, 0, 3. Соотношение этих типов коклюшных бактерий в разные годы и на различных территориях неодинаково. Наиболее вирулентен вариант 1, 2, 0. Коклюшные бактерии при развитии инфекционного процесса у больного и сохранении их на питательных средах претерпевают фазовые изменения вирулентности. По мере течения болезни постепенно изменяются морфологические признаки возбудителя, снижается его вирулентность, что, видимо, и объясняет уменьшение опасности больного как источника инфекции к концу болезни.
Сходное с коклюшем заболевание - паракоклюш - вызывает Bordetella parapertussis. Оба возбудителя имеют общие родовые антигены, что приводит после заболевания паракоклюшем к формированию частичного перекрестного иммунитета, не дающего, однако, полной защиты от заболевания коклюшем.
Источник возбудителя коклюша - больной, который наиболее опасен в начале заболевания, при катаральном кашле, когда возбудители интенсивно размножаются на слизистой оболочке верхних дыхательных путей и легко рассеиваются при кашле. В большинстве случаев заразный период заканчивается раньше, чем прекращается судорожный кашель. Больного изолируют на 25 дней. Больные легкими и стертыми формами коклюша своевременно не распознаются, они представляют наибольшую эпидемиологическую опасность. Носительство коклюшных бактерий возможно, однако оно непродолжительно и не играет существенной роли в распространении возбудителя.
Механизм передачи возбудителя - аспирационный; путь передачи - воздушно-капельный. Возбудитель выделяется при кашле и в капельках слизи распространяется на 1,5-2 м от источника инфекции. Коклюшные микробы нестойки в окружающей среде, быстро погибают при высыхании, поэтому игрушки, посуда, носовые платки не представляют опасности как факторы передачи. По этой же причине в эпидемическом очаге коклюша не проводят дезинфекцию. Заражение коклюшем восприимчивого индивидуума происходит при непосредственном длительном общении с больным, причем только на расстоянии, не превышающем 2 м.
Восприимчивость к коклюшу высока и не зависит от возраста. В возрасте до 1 года коклюш протекает тяжело, нередко с осложнениями. У детей старше 1 года выраженность клинических проявлений болезни во многом определяется полнотой и качеством проведенных им противококлюшных прививок (АКДС). На фоне иммунизации преобладают нетяжелые и стертые формы коклюша. Взрослые также могут болеть коклюшем. На основании тщательно выполненных бактериологических, серологических и клинических наблюдений в очагах установлено, что 20-30% взрослых, общавшихся с больным в семье, заболевают коклюшем. Выявление коклюша у взрослых обычно затруднено и запаздывает; нередко диагностируют бронхит. В связи с этим при длительном кашле у взрослого пациента необходимо выяснить эпидемиологический анамнез, расспросить о кашляющих детях в семье.
Изредка возможны повторные заболевания коклюшем, однако в каждом подобном случае необходимо с помощью бактериологических или серологических исследований исключить паракоклюш.
Для эпидемического процесса коклюша характерны периодические подъемы и спады заболеваемости. Обычная периодичность коклюшной инфекции составляет 3-4 года. Многолетняя динамика заболеваемости коклюшем на территории РФ и полнота охвата детей прививками представлены на рис. 10.6, 10.7.

Рис. 10.6. Многолетняя динамика заболеваемости коклюшем на территории Российской Федерации: А - в 1950-2008 гг.; Б - 2000-2011 гг.

Рис. 10.7. Заболеваемость коклюшем и уровень охвата прививками в возрасте 12 мес
В многолетней динамике эпидемического процесса коклюша отмечаются маловыраженные подъемы заболеваемости в 2003 г. (8,7 на 100 тыс. населения) и 2006 г. (5,74 на 100 тыс. населения) со стабилизацией показателя заболеваемости на уровне 2,5-3,8 на 100 тыс. населения.
Кроме того, эпидемический процесс коклюша характеризуется недостаточно четко выраженной сезонностью. Некоторый рост заболеваемости в осенне-зимнее время связан с увеличением риска заражения из-за большей тесноты и длительности общения с источником инфекции в закрытых помещениях.
Отмечается крайне неравномерное распределение заболеваемости по территории страны с разбросом показателей заболеваемости от 9,6 до 52,2 на 100 тыс. населения.
Показатели заболеваемости коклюшем городского населения в 3-3,5 раза выше сельского. Это обусловлено относительно низкой контагиозностью коклюшной инфекции и отсутствием соответствующих условий для реализации воздушно-капельного пути передачи возбудителя, а также низким уровнем диагностики в сельской местности.
Коклюш регистрируют в основном среди детей, на долю которых ежегодно приходится до 97% от общего количества больных. Максимальный показатель заболеваемости регистрируют среди детей до 1 года (44,2 на 100 тыс. детей данного возраста). Своевременность охвата прививками от коклюша детей в возрасте 12 мес в целом по РФ составляет около 97%.
Профилактические и противоэпидемические мероприятия. Объем противоэпидемических мероприятий в очаге коклюша представлен на схеме 10.7.
Схема 10.7. Работа в эпидемическом очаге коклюша Направленность и содержание противоэпидемических мероприятий

Вакцинопрофилактика коклюша оказалась высокоэффективной уже в первые годы ее применения - 1960-1965 гг. Отмечено снижение заболеваемости, уменьшение количества болеющих при вспышках в дошкольных детских учреждениях, преобладание легких и стертых форм болезни. Основная задача в профилактической работе состоит в организации и контроле за вакцинопрофилактикой, обоснованностью отводов и отказов от иммунизации АКДС; раннем выявлении больных.
Краснуха
Краснуха - антропонозная вирусная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется мелкопятнистой экзантемой, генерализованной лимфаденопатией, умеренной интоксикацией и поражением плода у беременных.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизмы и пути передачи возбудителя краснухи.
4. Эпидемический процесс краснухи.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - РНК-содержащий вирус семейства Togaviridae, рода Rubivirus. Вирус нестоек во внешней среде, термолабилен, инактивируется при температуре 56 °С в течение 1 ч, при комнатной температуре выживает несколько часов. Быстро погибает под воздействием ультрафиолетовых лучей и обычных дезинфекционных средств.
Источник возбудителя инфекции - больной с клинически выраженной или инаппарантно протекающей инфекцией и новорожденные с врожденной краснухой.
Больной краснухой представляет опасность для окружающих в последние 4-5 дней инкубационного периода, продромальный период, период высыпаний и еще 7-10 дней после окончания высыпаний. Наиболее опасный период - за 5 дней до высыпаний и 5-7 дней после появления сыпи, т.е. около 10-14 дней.
При легких и инаппарантных формах больной опасен 3-4 дня. У детей с врожденной краснухой вирус может выделяться в возрасте от 8 мес до 2 лет.
Механизмы передачи возбудителя - аспирационный и вертикальный. Пути передачи - воздушно-капельный и трансплацентарный.
Возбудитель представляет особую опасность для беременных, поскольку вирус поражает плод в течение первых 8-12 нед беременности, далее тератогенность быстро снижается. При внутриутробном заражении возможны мертворождение, развитие СВК (катаракта, пороки сердца, глухота), неполноценность, физические уродства.
Контагиозность краснухи невелика, для заражения необходим более тесный контакт, чем при ветряной оспе и кори.
Восприимчивость к краснухе высокая. После перенесенного заболевания развивается стойкий иммунитет.
Эпидемический процесс краснухи характеризуется цикличностью. Периодические подъемы заболеваемости регистрируют с интервалом 3-4 года, более выраженные - через 7-10 лет. Сезонность зимне-весенняя, особенно выражена в годы эпидемического подъема. Дети до года болеют очень редко, так как защищены материнскими антителами. Наиболее высокие показатели заболеваемости регистрируют среди детей 3-6 лет.
Дети, посещающие детские дошкольные учреждения, болеют чаще, чем дети, воспитываемые дома. В детских дошкольных учреждениях эпидемический процесс проявляется в виде вспышек, возникающих в результате заноса возбудителя краснухи.
Многолетняя динамика заболеваемости краснухой и своевременность охвата прививками представлена на рис. 10.8, 10.9.
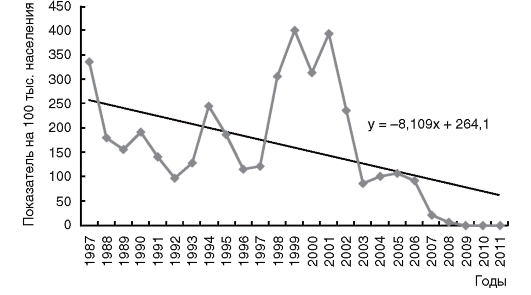
Рис. 10.8. Многолетняя динамика заболеваемости краснухой на территории Российской Федерации в 1987-2011 гг.
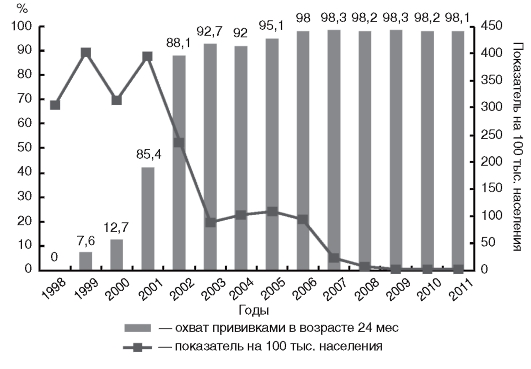
Рис. 10.9. Заболеваемость краснухой и уровень охвата прививками в возрасте 24 мес
Заболеваемость краснухой с 2007 по 2011 г. снизилась в 86 раз, что стало возможно благодаря введению плановой иммунизации в Национальный календарь профилактических прививок и формированию коллективного иммунитета. На этом фоне произошло смещение заболеваемости краснухой на старшие возрастные группы. В общей структуре заболеваемости доля взрослого населения составила около 60%, а детей до 17 лет включительно - около 40%. Случаи краснухи регистрируют в основном среди непривитого контингента; так, прививок против краснухи не имеют около 70% взрослых.
Профилактические и противоэпидемические мероприятия. Больного госпитализируют по клиническим показаниям с изоляцией до 7-го дня с момента появления сыпи. Дезинфекцию в очаге не проводят.
За людьми, контактировавшими с больным краснухой, устанавливают медицинское наблюдение в течение 21 дня с момента выявления последнего случая в очаге. В дошкольных организациях и общеобразовательных учреждениях, в организациях с круглосуточным пребыванием взрослых и детей проводят ежедневный осмотр контактировавших для активного выявления больных краснухой.
В случае общения беременной с больным краснухой необходимо серологическое исследование для обнаружения антител к вирусу краснухи (ИФА), по результатам которого определяют дальнейшую тактику (схема 10.8).
Схема 10.8. Алгоритм обследования беременной, контактировавшей с больным краснухой

Особое, первостепенное значение в профилактике краснухи имеет специфическая профилактика - плановая иммунизация детей, проводимая в сроки, предусмотренные Национальным календарем профилактических прививок.
Учитывая чрезвычайную актуальность профилактики врожденной краснухи, 48-я сессия Европейского регионального бюро ВОЗ в сентябре 1998 г. включила краснуху в число инфекций, борьба с которыми
будет определяться целями программы «Здоровье для всех в ХХI в.». Основной задачей программы на первом этапе ее реализации стало снижение к 2010 г. или раньше частоты СВК до уровня менее 0,01 на 1 тыс. родов живым ребенком.
Разрыв передачи возбудителя краснухи у детей младшего возраста - следующая задача, достижение которой возможно только при проведении плановой вакцинации.
Менингококковая инфекция
Менингококковая инфекция - антропонозная бактериальная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется лихорадкой, интоксикацией, геморрагической сыпью и гнойным воспалением оболочек мозга.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и путь передачи возбудителя.
4. Проявления эпидемического процесса менингококковой инфекции.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - грамотрицательный диплококк Neisseria meningitidis из семейства Neisseriaceae рода Neisseria. Менингококки исключительно требовательны к условиям выращивания на искусственных питательных средах - к составу сред и температурному режиму (36-37 °С). По структуре капсульного полисахарида различают 12 серогрупп (А, В, С, X, Y, Z, 29E, 135W). Внутри отдельных серогрупп (особенно В и С) обнаруживают антигенную неоднородность по белкам наружной мембраны, которые определяют субтип возбудителя.
Менингококк неустойчив к воздействию окружающей среды, он быстро погибает на свету, при низкой температуре, недостаточной влажности. Менингококк чувствителен к дезинфектантам.
Источник возбудителя инфекции - зараженные люди. Степень и опасность разных источников зависит от самого факта нахождения менингококка в ротоглотке и длительности этого состояния. Различают три группы источников инфекции: больные генерализованными формами менингококковой инфекции (ГФМИ) (примерно 1% от числа инфицированных); больные острым менингококковым назофарингитом (10-20% от общего числа инфицированных лиц); «здоровые» носители.
Больной ГФМИ наиболее опасен как источник инфекции в продромальном периоде, т.е. в течение 4-6 дней. У больных менингококковым назофарингитом заразный период продолжается около 2 нед. «Здоровые» носители опасны в течение 2-3 нед, и только у 2-3% лиц носительство продолжается 6 нед и более. Эпидемиологическая значимость разных источников инфекции неодинакова. Так, в продромальном периоде больные ГФМИ, имеющие катаральные изменения в носоглотке, остаются активными и опасными для окружающих. Ввиду редкости реконвалесцентного носительства переболевших выписывают из стационара после клинического выздоровления без бактериологического контроля. Больные назофарингитами и «здоровые» носители менингококка, т.е. люди с наиболее трудно выявляемыми формами инфекционного процесса, в большей степени способствуют инфицированию окружающих лиц, поддерживая непрерывность эпидемического процесса. При этом больные назофарингитами, у которых болезнь сопровождается кашлем и чиханьем, выделяют значительно большее количество возбудителя. В то же время количество носителей в сотни раз превышает количество больных ГФМИ, а уровень носительства подвержен значительным колебаниям. На 1 больного ГФМИ в зависимости от эпидемиологической ситуации может приходиться от 100 до 10 тыс. носителей. Пораженность носительством выше в эпидемических очагах, чем вне очагов. Наиболее высокий уровень носительства регистрируют среди взрослых, наименьший - среди детей до 2 лет.
Таким образом, основная, а возможно, и ведущая роль как источника возбудителя инфекции принадлежит больным менингококковым назофарингитом и «здоровым» носителям.
Механизм передачи возбудителя - аспирационный; путь передачи - воздушно-капельный.
Выделяясь в окружающую среду при кашле, чиханье и разговоре, менингококки попадают на слизистую оболочку носоглотки окружающих восприимчивых лиц. По сравнению с другими инфекциями, возбудители которых также передаются воздушно-капельным путем, применительно к менингококковой инфекции отмечают «вялый» механизм передачи возбудителя. Это своеобразие связывают с не очень мощным выбросом бактериального аэрозоля источником инфекции, быстрым оседанием крупнодисперсной фазы аэрозоля и быстрой гибелью возбудителя. Наряду с физическим распадом аэрозоля большое значение имеет биологическое отмирание возбудителя, поскольку установлено, что во внешней среде менингококк неустойчив. В связи с этим заражение человека возможно только в момент выделения возбудителя, когда он находится во взвешенном состоянии. Поэтому для реализации механизма передачи возбудителя требуются «близость» (0,5 м) и определенная экспозиция, т.е. длительность общения, с источником инфекции. В эпидемиологических наблюдениях не отмечено заражений при мимолетном общении восприимчивых с источниками инфекции, однако влияние длительности и близости общения на частоту инфицирования отчетливо отмечено в появлении «гнездных» заболеваний в спальных комнатах и столовых, в круглосуточных группах дошкольных детских учреждений, коллективах учащихся и военнослужащих в казармах. Нарушение санитарно-гигиенического режима, переуплотнение, повышенная влажность воздуха в помещении неизменно приводят к распространению возбудителя и возникновению групповых заболеваний менингококковой инфекцией.
Восприимчивость к менингококковой инфекции высокая, причем с весьма полиморфной ответной реакцией организма на внедрение возбудителя: от «здорового» носительства и назофарингита до развития генерализованных форм, т.е. способность к заражению реализуется в различных по проявлению клинических формах. Выраженная клиническая картина болезни развивается у немногих инфицированных, что, возможно, связано с недостаточным иммунологическим ответом организма на внедрение возбудителей.
Эпидемический процесс менингококковой инфекции имеет своеобразные черты, несколько отличные от типичных проявлений его при других инфекциях дыхательных путей. Периодические (циклические) подъемы заболеваемости регистрируют реже, интервал составляет от 10-15 до 30 лет. Многолетняя динамика заболеваемости менингококковой инфекцией представлена на рис. 10.10.
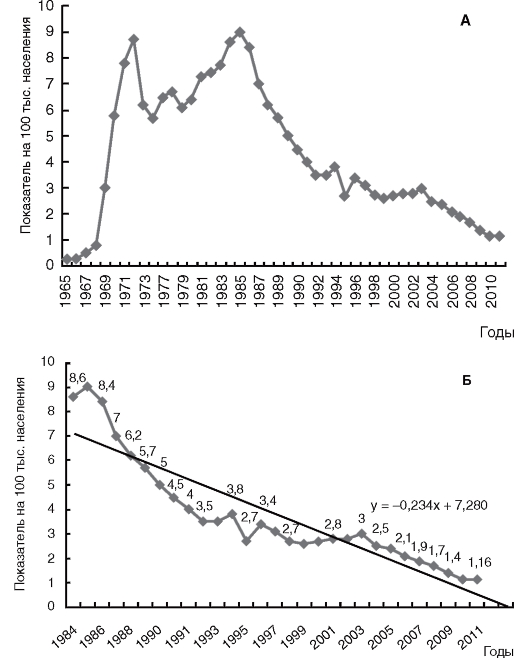
Рис. 10.10. Многолетняя динамика заболеваемости менингококковой инфекцией на территории Российской Федерации: А - в 1965-2010 гг.; Б - 1984-2011 гг.
Регистрируют спорадическую заболеваемость, вспышки, эпидемии, которые вызывают в основном менингококки серогрупп А, В и С.
Причины периодических подъемов объясняют сменой доминирующей серогруппы менингококка; появлением штаммов с измененными молекулярно-генетическими параметрами (селекция эпидемически опасных клонов со своеобразной антигенной структурой, например, по белкам внешней мембраны); нарастанием количества штаммов, устойчивых к сульфаниламидам и антибиотикам; увеличением количества лиц, восприимчивых к данной инфекции за счет естественного прироста населения (или выраженных миграционных процессов) и как следствие этого изменение (дестабилизация) иммунологической структуры к менингококку. Нельзя исключать и значение генетических факторов, определяющих восприимчивость к менингококковой инфекции как на уровне индивидуума, так, вероятно, и на расовом уровне. Предвестники подъема и спада заболеваемости менингококковой инфекцией приведены на схеме 10.9.
Схема 10.9. Предпосылки и предвестники подъема и спада заболеваемости менингококковой инфекции

Заболевания регистрируют во всех возрастных группах, а преимущественное поражение детей объяснимо отсутствием у них специфического иммунитета. Интенсивное общение жителей в городах ведет к формированию иммунитета после первого же инфицирования, происходящего в детских коллективах. Жители сельских районов нередко остаются неинфицированными длительный срок и заболевают при заражении, оказавшись в больших коллективах (заболеваемость новобранцев). Таким образом, социально-бытовые факторы во многом оказывают влияние на возрастную структуру заболеваемости, которая характеризуется преобладанием детских контингентов. На детей до 2 лет, заболевших менингококковой инфекцией, приходится около 30%. Для менингококковой инфекции характерна низкая очаговость: до 95% - это очаги с одним случаем заболевания.
Сезонные подъемы заболеваемости и носительства регистрируют в зимне-весенний период, т.е. позже, чем при других инфекциях дыхательных путей. Это явление объясняют как «вялым» механизмом передачи, так и социальными факторами: изменениями условий общения людей в холодное время года и снижением резистентности организма в конце зимы и весной.
Профилактические и противоэпидемические мероприятия. Противоэпидемическую работу начинают с подачи экстренного извещения в территориальный отдел Роспотребнадзора обо всех случаях ГФМИ и бактериологически подтвержденных назофарингитах. Объем проводимых противоэпидемических мероприятий в очаге представлен на схеме 10.10.
Схема 10.10. Работа в эпидемическом очаге менингококковой инфекции

Госпитализируют всех больных ГФМИ, а больных назофарингитами в ряде случаев разрешается лечить и наблюдать дома. Основаниями для этого служат легкое течение болезни, отсутствие дома детей дошкольного возраста и людей, работающих в дошкольных детских учреждениях.
Эпидемиолог определяет границы очага, выявляет всех общавшихся с больным. В течение первых 24 ч оториноларинголог осматривает людей, общавшихся с больным, для выявления больных острым назофарингитом и берет у них материал для бактериологического исследования до назначения лечения антибактериальными препаратами. Общавшимся с больным проводят термометрию в течение 10 дней. Особое внимание уделяют людям с обнаруженными хроническими воспалительными явлениями в носоглотке и неясными «аллергическими» высыпаниями на коже. Больных с патологическими изменениями в носоглотке изолируют, а при высыпаниях на коже госпитализируют для исключения менингококкемии. В детских дошкольных учреждениях, домах ребенка, школах-интернатах, детских санаториях в течение 10 дней после изоляции последнего больного запрещают переводы детей и персонала в другие группы или классы, прием временно отсутствовавших и новых детей. Бактериологическое обследование общавшихся с больным детей и всего обслуживающего персонала в детских дошкольных учреждениях проводят не менее 2 раз. В остальных коллективах - однократно.
Заключительную дезинфекцию в очаге не проводят, так как менингококки быстро погибают во внешней среде. В очагах, где ведется наблюдение за общавшимися с больным, необходимо частое проветривание, облучение бактерицидными лампами, ежедневная влажная уборка, максимальное разуплотнение в спальных и учебных комнатах.
В период сезонного подъема заболеваемости запрещается скопление детей на различных зрелищных мероприятиях, увеличиваются интервалы между сеансами в кинотеатрах. Необходима разъяснительная работа среди населения о раннем обращении к врачу при первых признаках болезни.
Специфическую профилактику проводят менингококковой вакциной, содержащей капсульный полисахарид менингококков серогруппы А, а также дивакциной (А+ С). Вакцину используют по эпидемическим показаниям и в эпидемических очагах по решению эпидемиолога (схема 10.11).
Схема 10.11. Профилактика менингококковой инфекции химической полисахаридной вакциной

Вакцина ареактогенна и безвредна, вызывает нарастание антител и защиту от болезни с 5-го дня после однократного введения, а через 2 нед содержание антител достигает максимального уровня. Ревакцинацию при наличии показаний проводят 1 раз в 3 года. При иммунизации с профилактической целью вакцину вводят не раньше чем через 1 мес после введения других вакцин, а при экстренной профилактике в эпидемических очагах - независимо от срока выполнения других прививок.
Эпидемический паротит
Эпидемический паротит - антропонозная вирусная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя. Характеризуется лихорадкой, общей интоксикацией, поражением слюнных желез, а иногда и других железистых органов (поджелудочной железы, половых желез, чаще яичек и др.), а также нервной системы.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и пути передачи возбудителя.
4. Проявления эпидемического процесса.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - РНК-содержащий вирус семейства Paramyxoviridae рода Paramyxovirus, малоустойчив в окружающей среде. Обладает гемагглютинирующей, нейраминидазной и гемолитической активностью.
Источник возбудителя инфекции - человек, больной типичной или атипичной, а также субклинической формой болезни. Вирус проникает в организм через слизистые оболочки рта, носа и глотки. После вирусемии возбудитель накапливается в околоушной железе, откуда со слюной выделяется в окружающую среду. Наибольшую опасность представляют больные атипичными и легкими формами болезни: оставаясь невыявленными или с диагнозом «лимфаденит», они могут быть приняты в детские дошкольные учреждения, оказаться в коллективе подростков в общежитиях или среди военнослужащих в казармах и на кораблях. Опасность больного для окружающих проявляется уже в конце инкубационного периода и продолжается до 9-го дня клинических проявлений, что определяет срок изоляции больного.
Механизм передачи возбудителя - аспирационный; путь передачи - воздушно-капельный. Вирус нестоек, быстро погибает в окружающей среде при воздействии ультрафиолетовых лучей, высушивания, других физических и химических факторов. В этой связи дезинфекцию в очагах не проводят. Для устранения путей передачи достаточно проветривания и обычной влажной уборки. Тем не менее контаминированные невысохшей слюной больного игрушки, посуда и другие предметы быта могут стать причиной заражения эпидемическим паротитом.
Восприимчивость к эпидемическому паротиту высокая, постинфекционный иммунитет стойкий и длительный.
Для эпидемического процесса характерны признаки, типичные для инфекций дыхательных путей: периодические подъемы заболеваемости наступают обычно с интервалом 5-7 лет, что объясняют накоплением неиммунных контингентов. Многолетняя динамика заболеваемости и полнота охвата детей прививками представлены на рис. 10.11, 10.12.

Рис. 10.11. Многолетняя динамика заболеваемости эпидемическим паротитом на территории Российской Федерации в 1960-2011 гг.

Рис. 10.12. Заболеваемость эпидемическим паротитом и уровень охвата прививками в возрасте 24 мес
Сезонные подъемы приходятся на осенне-зимнее время - период скученности детей и подростков в закрытых помещениях. Вспышки охватывают людей, находящихся в пределах квартиры, класса, группы детского учреждения, общежития, казармы. Вспышки эпидемического паротита из-за большой продолжительности инкубационного периода и наличия атипичных, легких, субклинических форм болезни оказываются длительными. Эпидемическим паротитом чаще болеют дети в возрасте 1-15 лет, при этом мальчики в 1,5 раза чаще девочек. У взрослых также возможно развитие заболевания, а в неиммунных коллективах, особенно в коллективах военнослужащих, могут возникать даже вспышки эпидемического паротита.
Профилактические и противоэпидемические мероприятия. Объем проводимых противоэпидемических мероприятий приведен на схеме 10.12.
Схема 10.12. Работа в эпидемическом очаге эпидемического паротита Направленность и содержание противоэпидемических мероприятий

Противоэпидемическую работу в очаге начинают с изоляции больного. Госпитализируют больных по клиническим и эпидемическим показаниям. Заключительную дезинфекцию в помещениях, где находился больной, не проводят; достаточно поддерживать обычный санитарно-гигиенический режим с регулярным проветриванием и влажной уборкой. При наблюдении за общавшимися с больным особое внимание уделяют детям до 1 года, а среди остальных - непривитым детям до 10 лет. Учитывая большую продолжительность инкубационного периода и заразительность только в последние дни этого периода, контактные в очаге могут посещать детские коллективы в течение первых 10 дней с момента общения с больным.
Во время медицинского наблюдения за контактными в эпидемическом очаге для раннего выявления среди них заболевших следует учитывать, что, помимо типичного для этой болезни увеличения околоушной слюнной железы, могут возникать поражение подчелюстных и подъязычных желез, у взрослых - орхиты, оофориты, маститы, в редких случаях - панкреатиты, менингиты.
При отсутствии противопоказаний к вакцинации ранее непривитым детям для защиты от болезни следует ввести живую паротитную вакцину.
Плановая иммунизация приводит к снижению заболеваемости эпидемическим паротитом, в первую очередь у детей прививаемого возраста.
Скарлатина
Скарлатина - антропонозная бактериальная острая инфекционная болезнь с аспирационным механизмом передачи возбудителя, характеризующаяся лихорадкой, интоксикацией, тонзиллитом и мелкоточечной сыпью.
Основные вопросы темы
1. Характеристика возбудителя.
2. Источник возбудителя инфекции.
3. Механизм и пути передачи возбудителя.
4. Эпидемический процесс скарлатины.
5. Профилактические и противоэпидемические мероприятия.
Возбудитель - β-гемолитический стрептококк группы A семейства Streptococcaceae рода Streptococcus. Грамположительный кокк, облигатный патогенный паразит человека, с которым этиологически связаны различные клинические формы стрептококковой инфекции: ангина, хронический тонзиллит, скарлатина, ревматизм, острый гломерулонефрит, стрептодермии, рожа и др. Стрептококк достаточно устойчив во внешней среде, может длительно сохраняться вне организма на предметах, окружающих больного, остается жизнеспособным при высыхании мокроты и гноя, на игрушках, постельных принадлежностях. При температуре 56-60 °С стрептококки погибают в течение 30 мин; чувствительны к дезинфектантам.
Источники возбудителя инфекции - больной ангиной, скарлатиной, респираторной стрептококковой инфекцией других клинических форм, а также носитель стрептококка группы А. Среди людей, зараженных стрептококками группы А, наиболее опасен больной скарлатиной. Его заразительность проявляется с первых признаков заболевания и с наибольшей отчетливостью выражена в первые дни болезни, когда возбудитель выделяется с секретом слизистых оболочек из носа, зева, с отделяемым гнойных очагов при отитах, синуситах, гнойных лимфаденитах. Наибольшую эпидемиологическую опасность представляют больные легкими и атипичными формами болезни. Диагностика этих форм болезни затруднена, что приводит к поздней изоляции больных в эпидемических очагах. Заразный период у больных скарлатиной продолжается до 3-й недели болезни; у реконвалесцентов при отсутствии у них осложнений сохраняется 12 дней. Опасность реконвалесцентов возрастает при реинфекции другими типами стрептококка.
Механизм передачи возбудителя - аспирационный, реализуется главным образом воздушно-капельным путем при выделении возбудителя с капельками слизи.
При этом распространение стрептококков происходит на относительно небольшое расстояние в пределах одной комнаты. Воздушно-пылевой путь и заражение через предметы бытового пользования (посуда, полотенце, игрушки) возможны, поскольку стрептококки сохраняются в высушенном состоянии, и попадание их на слизистые оболочки ротовой полости приводит к развитию заболевания.
В замкнутых пространствах, где организованные коллективы детей и взрослых находятся круглосуточно, воздушно-капельный путь передачи возбудителя наиболее интенсивен в спальных помещениях, игровых комнатах, местах длительного пребывания членов коллектива. Однако при расстоянии между людьми более 3 м этот путь передачи возбудителя практически не срабатывает (рис. 10.13).

Рис. 10.13. Взаимосвязь между вероятностью заражения (Р) стрептококком и расстоянием (в метрах) от источника инфекции до реципиента (полулогарифмическая шкала). Крестиками обозначены эмпирические частоты заражений (по Покровскому В.И., Брико Н.И., Ряпису Л.А., 2006)
К дополнительным факторам, способствующим передаче возбудителя, относят низкую температуру и высокую влажность воздуха в помещениях, так как в этих условиях дольше сохраняется капельная фаза аэрозоля, в которой возбудитель содержится в вирулентном состоянии.
Пищевой путь передачи относительно редкий, он реализуется при заражении носителями молока, мороженого, кремов и проявляется вспышечной заболеваемостью.
Восприимчивость к скарлатине высокая, но неодинакова в младших и старших возрастных группах. Очень редко проявляются заболевания у детей до 3 мес жизни; наибольшее количество заболевших отмечено до 7-летнего возраста; в старшем возрасте и у взрослых их число невысокое. Восприимчивость к стрептококку не всегда реализуется в виде манифестной формы болезни, некоторое число восприимчивых переносит инфекцию в виде носительства. Особенностью скарлатины являются повторные заболевания у детей и взрослых, что связывают с формированием недостаточно напряженного иммунитета. Скарлатина возникает у людей, не имеющих антитоксического иммунитета, при их инфицировании токсигенными штаммами бактерий, продуцирующих эритрогенные токсины типов А, В и С. Постинфекционный иммунитет типоспецифический, при инфицировании стрептококками А другого серовара возможно повторное заболевание.
Эпидемический процесс. Скарлатина распространена повсеместно, но чаще встречается в регионах с умеренным и холодным климатом. Характерна связь скарлатины с предшествующими заболеваниями ангиной и другими респираторными проявлениями стрептококковой инфекции. Заболеваемость в осенне-зимне-весенний период наиболее высока. В эпидемическом процессе скарлатины прослеживается периодичность подъемов заболеваемости с интервалом в 2-4 года. Наряду с этими интервалами можно выделить и более длительные временные промежутки (40-50 лет) с ростом числа заболевших (рис. 10.14).

Рис. 10.14. Многолетняя динамика заболеваемости скарлатиной в России в 1890-2001 гг. (по В.И. Покровскому, Н.И. Брико, Л.А. Ряпису)
Многолетняя динамика заболеваемости скарлатиной представлена на рис. 10.15.

Рис. 10.15. Многолетняя динамика заболеваемости скарлатиной на территории Российской Федерации в 1985-2011 гг.
Профилактическая и противоэпидемическая работа. Средства специфической профилактики скарлатины отсутствуют, поэтому основное внимание уделяют неспецифической профилактике в виде таких мер, как закаливание детей, соблюдение санитарно-гигиенического режима в детских учрежде






