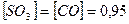1. Энергетика химических процессов
(термохимические расчеты)
1.1. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля метана, в результате которой образуются пары воды и диоксид углерода.
1.2. Вычислите тепловой эффект реакции восстановления одного моля 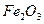 металлическим алюминием.
металлическим алюминием.
1.3. При взаимодействии трех молей оксида азота  с аммиаком образуются азот и пары воды. Тепловой эффект реакции равен (+877,76 кДж) Напишите термохимическое уравнение этой реакции и вычислите теплоту образования
с аммиаком образуются азот и пары воды. Тепловой эффект реакции равен (+877,76 кДж) Напишите термохимическое уравнение этой реакции и вычислите теплоту образования 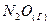 .
.
1.4. При сгорании газообразного аммиака образуются пары воды и монооксид азота 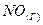 . Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на один моль
. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на один моль 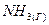 .
.
1.5. Напишите термохимическое уравнение горения 1 моля этилового спирта, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования  , если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты.
, если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты.
1.6. Газообразный этиловый спирт можно получить при взаимодействии этилена  и водяных паров. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект. Сколько теплоты выделится, если в реакцию вступило 10 л
и водяных паров. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект. Сколько теплоты выделится, если в реакцию вступило 10 л 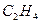 при нормальных условиях?
при нормальных условиях?
1.7. Напишите термохимическое уравнение реакции горения одного моля этана 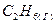 , в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия?
, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия?
1.8. Теплота растворения безводного хлорида стронция 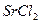 равна (- 47,70 кДж), а теплота растворения кристаллогидрата
равна (- 47,70 кДж), а теплота растворения кристаллогидрата 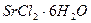 равна (+30,96 кДж). Вычислите теплоту гидратации
равна (+30,96 кДж). Вычислите теплоту гидратации 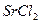 .
.
1.9. Теплоты растворения сульфата меди 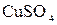 и кристаллогидрата
и кристаллогидрата 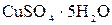 соответственно равны (- 66,11 кДж) и (+ 11,72 кДж). Вычислите теплоту гидратации
соответственно равны (- 66,11 кДж) и (+ 11,72 кДж). Вычислите теплоту гидратации 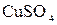 .
.
1.10. Реакция горения этана выражается термохимическим уравнением:
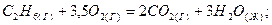
 Н = -1559,87 кДж
Н = -1559,87 кДж
Вычислить теплоту образования этана, если известны теплоты образования  и
и 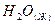 .
.
1.11. Реакция горения этилового спирта выражается термохимическим уравнением:
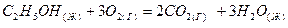 ;
;  Н
Н
Вычислить тепловой эффект реакции, если известно, что мольная теплота парообразования  равна (+ 42,36 кДж) и известны теплоты образования:
равна (+ 42,36 кДж) и известны теплоты образования:  ,
,  ,
, 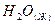 .
.
1.12. Значения энтальпии растворения в воде 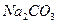 и
и 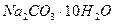 составляют соответственно (-25,10 и + 66,94 кДж). Вычислите энтальпию гидратации
составляют соответственно (-25,10 и + 66,94 кДж). Вычислите энтальпию гидратации  .
.
1.13. Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита составляет -393,51 кДж, а теплота фазового перехода 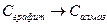 равна + 1,88 кДж.
равна + 1,88 кДж.
1.14. Вычислите, какое количество теплоты выделится при восстановлении 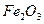 металлическим алюминием, если было получено 335,1 г железа.
металлическим алюминием, если было получено 335,1 г железа.
1.15. Теплота растворения  равна +8.66 кДж/моль, а теплота гидратации этой соли при переходе в
равна +8.66 кДж/моль, а теплота гидратации этой соли при переходе в 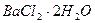 составляет +29,16 кДж/моль. Какова теплота растворения
составляет +29,16 кДж/моль. Какова теплота растворения  ?
?
1.16. Вычислите 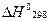 хлорида аммония, если для реакции
хлорида аммония, если для реакции
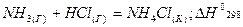 = -176,93 кДж/моль.
= -176,93 кДж/моль.
1.17. При растворении 16 г 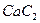 в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования
в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования  .
.
1.18. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный, если  = -18,41 кДж/моль;
= -18,41 кДж/моль;
 = -43,20 кДж/моль?
= -43,20 кДж/моль?
1.19. При сгорании 9,3 г фосфора выделяется 229,5 кДж теплоты. Рассчитайте  оксида фосфора (V).
оксида фосфора (V).
1.20. Сколько теплоты выделится при разложении 54 г глюкозы по реакции: 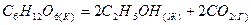 ,
,
если 
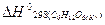 = -1273,0 кДж/моль;
= -1273,0 кДж/моль; 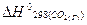 = -393,5 кДж/моль.
= -393,5 кДж/моль.
Химическое сродство
2.1.Вычислите изменение энтропии в результате реакции образования аммиака из азота и водорода. При расчете можно исходить из  соответствующих газов. Чем можно объяснить отрицательное значение соответствующих газов. Чем можно объяснить отрицательное значение  S?
2.2.Определите S?
2.2.Определите 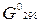 реакции, протекающей по уравнению: реакции, протекающей по уравнению:
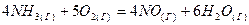 Вычисления сделайте на основании стандартных теплот образования и стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях.
Вычисления сделайте на основании стандартных теплот образования и стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях.
| ||
2.3.Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению:
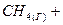 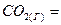 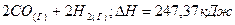 При какой температуре начнется реакция?
При какой температуре начнется реакция?
| ||
2.4. Вычислите стандартные значения 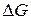 для реакций: для реакций:
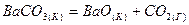
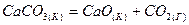 и определите, какой из карбонатов обладает большей термической устойчивостью?
и определите, какой из карбонатов обладает большей термической устойчивостью?
| ||
2.5.Вычислите возможность протекания при стандартных условиях реакции:
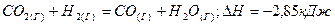
| ||
2.6. Вычислите изменение энергии Гиббса при 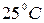  для процесса: для процесса:
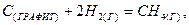 зная зная  и и  метана. метана.
| ||
2.7.В каком направлении нижеприведенная реакция будет протекать самопроизвольно:
 Необходимые для расчета
Необходимые для расчета 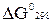 реагирующих веществ взять из справочной литературы. реагирующих веществ взять из справочной литературы.
| ||
2.8.Определите, при какой температуре начнется реакция восстановления: 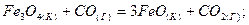 
| ||
2.9.Образование сероводорода из простых веществ протекает по уравнению
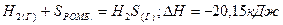 Исходя из значений
Исходя из значений  соответствующих веществ определите соответствующих веществ определите 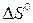 и и
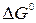 для этой реакции в стандартных условиях. для этой реакции в стандартных условиях.
| ||
2.10. Вычислите возможность протекания при стандартных условиях реакции:

| ||
2.11.Вычислите изменение энергии Гиббса при   для процесса: для процесса:
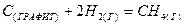 ,
зная ,
зная  и и  , сделать вывод о возможности протекания самопроизвольного процесса. , сделать вывод о возможности протекания самопроизвольного процесса.
| ||
2.12.Вычислите значения 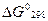 , ,  для процесса: для процесса:
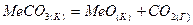 ,
и составьте ряд термической стабильности карбонатов ,
и составьте ряд термической стабильности карбонатов 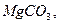  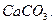
| ||
2.13.Какие из приведенных реакций протекают самопроизвольно и являются экзотермическими:
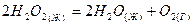

| ||
2.14.Укажите, какая из двух реакций будет протекать самопроизвольно:
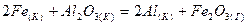 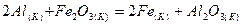
| ||
2.15.В каком направлении ниже приведенная реакция будет протекать самопроизвольно:
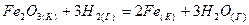  Рассчитать с использованием
Рассчитать с использованием 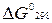 веществ. веществ.
| ||
2.16. На основании значений  и и  веществ вычислите веществ вычислите 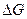 0 для следующих процессов: 0 для следующих процессов:

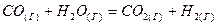 Укажите, в каком направлении эти реакции будут протекать, приближаясь к равновесию.
Укажите, в каком направлении эти реакции будут протекать, приближаясь к равновесию.
| ||
2.17.Определить стандартное изменение энтропии при 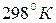 для следующих реакций: для следующих реакций:
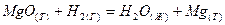
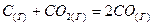 Сделать вывод о возможности самопроизвольного протекания реакций.
Сделать вывод о возможности самопроизвольного протекания реакций.
| ||
2.18.Для каких оксидов  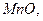 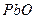 принципиально осуществима реакция восстановления водородом в стандартных условиях, выводы сделайте на основании расчета принципиально осуществима реакция восстановления водородом в стандартных условиях, выводы сделайте на основании расчета 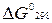
| ||
2.19.Пользуясь значениями 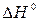 и и 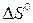 вычислить вычислить 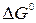 реакций: реакций:

 Сделать вывод о возможности самопроизвольного протекания реакции.
Сделать вывод о возможности самопроизвольного протекания реакции.
| ||
2.20.Реакция горения ацетилена протекает по уравнению:
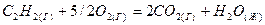 Вычислите
Вычислите 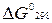 и и  и объясните уменьшение энтропии в результате этой реакции. и объясните уменьшение энтропии в результате этой реакции.
| ||
Химическая кинетика
3.1. Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению А + 2В = АВ2 и определите, во сколько раз увеличится скорость этой реакции, если: а) концентрация вещества А увеличится в 2 раза; б) концентрация вещества В увеличится в 2 раза; в) давление увеличится в 2 раза.
3.2. Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 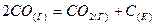 , чтобы скорость реакции увеличилась в 4 раза?
, чтобы скорость реакции увеличилась в 4 раза?
3.3. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 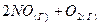 ⇄
⇄  , возросла в 1000 раз?
, возросла в 1000 раз?
3.4. Напишите выражение для скорости реакции 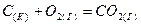 и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в 3 раза.
и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в 3 раза.
3.5. Реакция между оксидом азота (II) и хлором протекает по уравнению  ⇄
⇄ 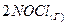 . Как изменится скорость реакции при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза?
. Как изменится скорость реакции при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза?
3.6. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40°С, если γ = 3,2?
3.7. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)?
3.8. При повышении температуры на 50°С скорость реакции возросла в 1200 раз. Вычислите температурный коэффициент реакции.
3.9. Как изменится скорость прямой реакции
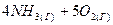 ⇄
⇄ 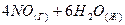 , если объем газовой смеси уменьшить в 3 раза?
, если объем газовой смеси уменьшить в 3 раза?
3.10. Во сколько раз следует увеличить давление в системе
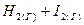 ⇄
⇄ 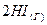 , чтобы скорость образования HI возросла в 16 раз?
, чтобы скорость образования HI возросла в 16 раз?
3.11. Температурный коэффициент реакции равен 3. Вычислите, во сколько раз увеличится скорость реакции при увеличении температуры с 22 до 62°С?
3.12. Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гомогенной системе:
a) 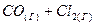 ⇄
⇄  ;
;
б) 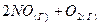 ⇄
⇄  ;
;
в) 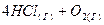 ⇄
⇄ 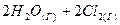 .
.
3.13. Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гетерогенной системе:
а) 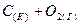 ⇄
⇄  ;
;
б) 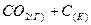 ⇄
⇄ 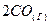 ;
;
в) 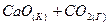 ⇄
⇄  .
.
3.14. Определите, как изменится скорость прямой реакции 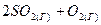 ⇄
⇄  , если давление в системе увеличить в 5 раз?
, если давление в системе увеличить в 5 раз?
3.15. Как изменится скорость прямой реакции
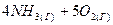 ⇄
⇄ 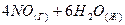 , если объем газовой смеси уменьшить в 2 раза?
, если объем газовой смеси уменьшить в 2 раза?
3.16. При повышении температуры на 30°С скорость химической реакции увеличилась в 64 раза. Вычислите, во сколько раз увеличится скорость этой реакции при повышении температуры на каждые 10°С.
3.17. Рассчитайте температурный коэффициент реакции, если при нагревании системы от 40°С до 80°С скорость возросла в 64 раза.
3.18. Температурный коэффициент реакции равен 3. При какой температуре следует проводить эту реакцию, чтобы скорость реакции, идущей при 100°С, уменьшилась в 27 раз?
3.19. Как изменится скорость прямой и обратной реакции, если объем газовой смеси 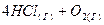 ⇄
⇄ 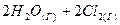 увеличить в 2 раза?
увеличить в 2 раза?
3.20. Как и во сколько раз следует изменить давление в системе
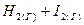 ⇄
⇄ 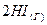 , чтобы скорость образования HI возросла в 100 раз?
, чтобы скорость образования HI возросла в 100 раз?
4. Химическое равновесие
4.1. Напишите выражение для константы равновесия следующего обратимого процесса:  ⇄
⇄ 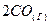
4.2. При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2] = 2,5; [H2] = 1,8; [NH3] = 3,6 моль/л. Рассчитайте значение константы равновесия и исходные концентрации.
4.3. Как повлияет повышение давления и температуры на равновесие следующих обратимых реакций:
а) 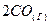 ⇄
⇄ 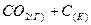 , ∆Н < 0
, ∆Н < 0
б) 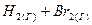 ⇄
⇄ 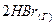 , ∆H < 0
, ∆H < 0
в) 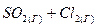 ⇄
⇄ 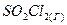 , ∆H > 0
, ∆H > 0
4.4. Используя справочные данные (см. Пособие, табл. 1), определите, в какую сторону произойдет смещение равновесия гомогенных реакций:
 ⇄
⇄ 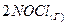 и
и
 ⇄
⇄ 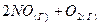
при следующих воздействиях:
а) охлаждение системы;
б) увеличение давления.
4.5. Константа равновесия для реакции 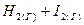 ⇄
⇄ 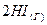 равна 36, а начальные концентрации водорода и иода равны по 0,02 моль/л. Вычислить равновесные концентрации водорода, иода и иодоводорода.
равна 36, а начальные концентрации водорода и иода равны по 0,02 моль/л. Вычислить равновесные концентрации водорода, иода и иодоводорода.
4.6. Исходные концентрации 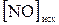 и
и 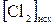 в гомогенной системе
в гомогенной системе  ⇄
⇄ 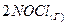 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
4.7. Почему при изменении давления смещается равновесие системы  ⇄
⇄ 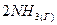 и не смещается равновесие системы
и не смещается равновесие системы  ⇄
⇄ 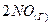 ? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем.
? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем.
4.8. При некоторой температуре равновесие в гомогенной системе 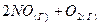 ⇄
⇄  установилось при следующих концентрациях реагирующих веществ:
установилось при следующих концентрациях реагирующих веществ: 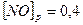
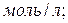
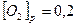
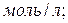
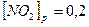
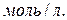 Вычислите константу равновесия.
Вычислите константу равновесия.
4.9. Константа равновесия гомогенной системы  ⇄
⇄ 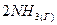 при некоторой температуре равна 0,2. Равновесные концентрации водорода и аммиака соответственно равны 0,4 и 0,15 моль/л. Вычислите исходную и равновесную концентрации азота.
при некоторой температуре равна 0,2. Равновесные концентрации водорода и аммиака соответственно равны 0,4 и 0,15 моль/л. Вычислите исходную и равновесную концентрации азота.
4.10. Константа равновесия системы при постоянной температуре 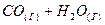 ⇄
⇄ 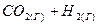 равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют:
равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: 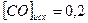

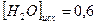

4.11. Равновесие гомогенной системы при Т=const
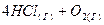 ⇄
⇄ 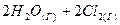 установилось при следующих концентрациях:
установилось при следующих концентрациях: 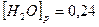



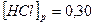


 Вычислите исходные концентрации хлороводорода и кислорода.
Вычислите исходные концентрации хлороводорода и кислорода.
4.12. Напишите выражение для константы равновесия гетерогенной системы  ⇄
⇄ 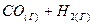 . Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции?
. Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции?
4.13. Напишите выражение для константы равновесия гетерогенной системы 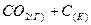 ⇄
⇄ 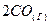 . Что необходимо предпринять для повышения выхода оксида углерода? Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза?
. Что необходимо предпринять для повышения выхода оксида углерода? Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза?
4.14. Составьте выражение для константы равновесия реакции, протекающей в закрытой системе при постоянной температуре:
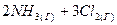 ⇄
⇄ 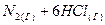 .
.
4.15. Установите, во сколько раз уменьшится или увеличится равновесная концентрация оксида углерода в реакции: 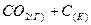 ⇄
⇄ 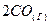 при увеличении значения равновесной концентрации диоксида углерода в 3 раза.
при увеличении значения равновесной концентрации диоксида углерода в 3 раза.
4.16. Как увеличить выход продуктов реакций
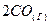 ⇄
⇄ 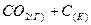 ,
, 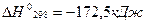
 ⇄
⇄ 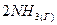 ,
, 
за счет изменения концентрации реагентов, давления, температуры?
4.17. Вычислите константу равновесия для следующей реакции 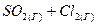 ⇄
⇄ 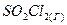 , если при некоторой температуре образовалось 2,3 моль
, если при некоторой температуре образовалось 2,3 моль 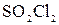 , а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/ли5,5 моль/л.
, а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/ли5,5 моль/л.
4.18. Вычислите константу равновесия реакции 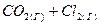 ⇄
⇄  , если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль
, если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль  .
.
4.19. Константа равновесия системы 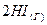 ⇄
⇄ 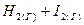 равна 0,35. Определите равновесные концентрации
равна 0,35. Определите равновесные концентрации 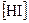 и
и 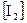 , если исходная концентрация йодоводорода равна 2 моль/л.
, если исходная концентрация йодоводорода равна 2 моль/л.
4.20. Вычислите равновесные концентрации веществ в реакции 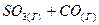 ⇄
⇄  , если константа равновесия реакции равна 1,89, а исходная концентрация
, если константа равновесия реакции равна 1,89, а исходная концентрация