Примеры:
P2O5 + 3H2O ®2H3PO4 (при нагревании)
*P2O5 + H2O ®HPO3 (на холоду)
SiO2 + H2O ® реакция не идет, т.к. H2SiO3 нерастворима в воде
б) взаимодействие с основными и амфотерными оксидами (см. пункт 6.в)
г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со щелочами, при этом образуется соль и вода. Пример:
2NaOH + CO2® Na2CO3 + H2O (в избытке NaOH)
NaOH + CO2 ®NaHCO3 (в избытке CO2)
д) взаимодействие с солями. Правило:
– при нагревании менее летучий оксид вытесняет из соли более летучий оксид.
Пример: Na2CO3 + SiO2 ®Na2SiO3 + CO2 (при нагревании)
– в растворе оксид, соответствующий более сильной кислоте, вытесняет из соли оксид, соответствующий более слабой кислоте.
– оксиды могут взаимодействовать с солями, содержащими остаток кислоты, которой этот оксид соответствует:
Na2CO3 +CO2 + H2O® 2NaHCO3
Na2SO3 +SO2 + H2O® 2NaHSO3
Пример: Na2SiO3 + CO2 ®Na2CO3 + SiO2¯ (в растворе)
8). Химические свойства амфотерных оксидов.
а) амфотерные оксиды не реагируют с водой
б) амфотерные оксиды в реакциях с кислотами проявляют основные свойства, т.е. реакции протекают так же, как с основными оксидами
Пример: Al2O3 + 6HCl ®2AlCl3 + 3H2O
в) взаимодействие со щелочами. В зависимости от условий реакции протекают по-разному:
Al2O3 + 2NaOH + 3H2O ®2Na[Al(OH)4] (в растворе)
Al2O3 + 2NaOH ®2NaAlO2 + H2O(при нагревании)
г) взаимодействие с основными оксидами (см №6г)
д) при взаимодействии с кислотными оксидами амфотерные оксиды проявляют основные свойства.
Пример: Al2O3 + P2O5 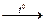 2AlPO4
2AlPO4
е) При взаимодействии с солями амфотерные оксиды, как нелетучие, вытесняют из солей при нагревании более летучие оксиды.
Пример: Na2CO3 + Al2O3 ®2NaAlO2 + CO2
| оксид | Гидроксид, основная форма | Гидроксид, кислотная форма (при нагревании) | Гидроксид, кислотная форма (в растворе) |
| BeO | Be(OH)2 | H2BeO2 | H2[Be(OH)4] |
| ZnO | Zn(OH)2 | H2ZnO2 | H2[Zn(OH)4] |
| SnO | Sn(OH)2 | H2SnO2 | H2[Sn(OH)4] |
| PbO | Pb(OH)2 | H2PbO2 | H2[Pb(OH)4] |
| Al2O3 | Al(OH)3 | HAlO2 | H[Al(OH)4] |
| Cr2O3 | Cr(OH)3 | HCrO2 | H3[Cr(OH)6] |
| Fe2O3 | Fe(OH)3 | HFeO2 | H3[Fe(OH)6] |
Примечание: кислотная форма амфотерных гидроксидов составлена формально, т.к. в реакциях со щелочами и с основными оксидами могут быть образованы только соли приведенных форм гидроксидов.
9). Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Пример: Cr+2O – основный оксид, Cr2+3O3 – амфотерный оксид, Cr+6O3 – кислотный оксид.
Кислоты.
I Определение.
а) кислоты – сложные вещества, состоящие из кислотных остатков и атомов водорода, способных замещаться на атомы металлов
б) кислоты – электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода.
II Классификация
а) по наличию или отсутствию атомов кислорода кислоты делят на бескислородные (H2S, HCl и др.) и кислородосодержащие (H2SO4, HNO3 и др.)
б) по числу атомов водорода, способных замещаться на металлы или по числу ионов H+, образующихся при диссоциации кислоты выделяют кислоты одноосновные (HNO3, HCl), двухосновные (H2S, H2SO4,), трехосновные (H3PO4), четырехосновные (H4P2O7)
в) по способности к диссоциации кислоты разделяют на сильные электролиты (HCl, HNO3, H2SO4 и др.), слабые электролиты (H2S, H2CO3, HF), электролиты средней силы (H3PO4, H2SO3 ).
г) по летучести выделяют нелетучие кислоты (H3PO4, H2SiO3, H2SO4) и летучие (HNO3, HCl, HF, H2S H2CO3, H2SO3)
д) стабильные (H3PO4, H2SO4) и нестабильные (H2SO3, H2CO3) кислоты
Нестабильные кислоты разлагаются в момент получения:
H2SO3 ® SO2 + H2O
H2CO3® CO2 + H2O
III Структурные формулы кислот.
IV Физические свойства кислот. Существуют кислоты твердые (H3PO4, H2SiO3), жидкие кислоты (H2SO4, HNO3)
V Способы получения кислот:
а) бескислородные кислоты получают растворением соответствующего газа в воде
б) кислородосодержащие получают при взаимодействии соответствующего оксида в воде:
P2O5 + 3H2O ®2H3PO4
в) нерастворимые кислоты получают косвенным путем:
Na2SiO3 + 2HCl ® H2SiO3¯+ 2NaCl
VI Химические свойства кислот.
1). Кислоты реагируют с металлами, стоящими в ряду активности левее водорода; при этом образуется соль и водород. При протекании таких процессов металл растворяется в кислоте (в ходе реакции не должна образовываться нерастворимая соль: H2SO4 + Mg ® MgSO4 + H2
Примечание 1:
при взаимодействии металлов со слабыми многоосновными кислотами образуются кислые соли:
Fe + 2H3PO4 → Fe(H2PO4)2 + 3H2
Ca + 2H2CO3 → Ca(HCO3)2 + H2
Примечание 2:
Кремниевая кислота (H2SiO3) не взаимодействует с металлами (твердое не реагирует с твердым)
Примечание 3:
Концентрированная серная и азотная кислота любой концентрации реагируют с металлами без выделения водорода (см. ниже)
2). Кислоты реагируют с основными оксидами
Примечание: некоторые реакции требуют нагревания:
CuO + H2SO4® CuSO4 + H2O (требуется нагревание)
MgO + H2SO4 ® MgSO4 + H2O (эта реакция протекает при комнатной температуре)
3). Кислоты реагируют с основаниями.
Примечание: слабые нерастворимые основания не реагируют со слабыми кислотами.
2Al(OH)3 + 3H2SO4 ® Al2(SO4)3 + 6H2O
Al(OH)3 + H2CO3 – реакция не идет.
4). Кислоты реагируют с солями при выполнении условий:
а) в ходе реакции выпадает осадок
BaCl2 + H2SO4® BaSO4¯ + 2HCl
Примечание: с помощью сероводорода можно осадить из солей в виде сульфидов металлы, стоящие в ряду активности правее железа:
CuSO4 + H2S ® CuS¯+ H2SO4
Т.к. сульфиды железа, цинка, магния и т.д. растворимы в разбавленных кислотах, то
FeSO4 + H2S ® реакция не идет
б) в ходе реакции выделяется газ
K2CO3 + 2HCl ®2KCl + H2O + CO2
в) нелетучие кислоты могут вытеснять летучие из их солей:
NaCl(тв.) + H2SO4(конц.)®HCl + NaHSO4 (при слабом нагревании)
2NaCl(тв.) + H2SO4(конц.)®2HCl + Na2SO4 (при сильном нагревании)
KNO3(тв.) + H2SO4(конц.)® HNO3 + KHSO4
5). Растворы кислот изменяют окраску индикаторов:
лакмус и метилоранж – в красный.
Мнемотаблица для запоминания окраски индикаторов в зависимости от реакции среды:
| Кислая | нейтральная | щелочная | |
| Лакмус | 4 К расный | 8 Ф иолетовый | 3 С иний |
| Метиловый оранжевый | 6 Кр асный | 2 О ранжевый | 7 Ж елтый |
| фенолфталеин | 1 Б есцветный | 9 Б есцветный | 5 М алиновый |
Таблица заполняется только первыми буквами приведенных в них слов (см. ниже). Заполнение происходит следующим образом: а) по горизонтали верхняя строка по алфавиту;
б) по вертикали левая строка также по алфавиту; в) далее из букв по порядку складываем мнемофразу (как «Каждый охотник желает знать…») «Бос и Комкр ы ж овником играют в ф ут б ол» (жирным подчеркнутым шрифтом выделены буквы из таблицы)
| К | Н | Щ | |
| Л | 4 К | 8 Ф | 3 С |
| М | 6 Кр | 2 О | 7 Ж |
| Ф | 1 Б | 9 Б | 5 М |






