Оксиды.
1). Определение: оксиды – сложные вещества, состоящие из 2-х элементов, один из которых кислород в степени окисления –2.
2). Классификация. Оксиды разделяют на две группы: солеобразующие и несолеобразующие (индифферентные) (NO, CO, N2O, SiO); в свою очередь, солеобразующие делятся на кислотные, основные и амфотерные оксиды.а) кислотными называются оксиды, которым соответствуют кислоты (гидроксиды, обладающие кислотными свойствами); неметаллы в любой степени окисления и металлы в с.о. +5, +6, +7 образуют кислотные оксиды.
Примеры: SO3 - H2SO4, CO2 - H2CO3, N2O5 - HNO3, Cl2O7- HClO4, CrO3- H2CrO4 (H2Cr2O7), Mn2O7 – HMnO4
б) основными называются оксиды, которым соответствуют основания (гидроксиды, обладающие основными свойствами); металлы в степени окисления +1 и +2 образуют основные оксиды. Примеры: Na2O- NaOH, CaO – Ca(OH)2, MnO – Mn(OH)2, CrO – Cr(OH)2.
в) амфотерными называются оксиды, которые могут проявлять как кислотные, так и основные свойства. Примеры: Al2O3, Cr2O3, ZnO, BeO. Амфотерным оксидам соответствуют амфотерные гидроксиды (см.ниже)
3). Физические свойства оксидов. Оксиды металлов – твердые вещества, имеющие различную окраску: большинство этих соединений не окрашены, FeO, CuO – черные, Cr2O3 – зеленый, CrO3 - красный. Оксиды неметаллов имеют различное агрегатное состояние – от газообразного до твердого; например, CO2, SO2 – газы, SO3, Cl2O7 – жидкости, P2O5, SiO2 – твердые.
4). Способы получения оксидов.
а) горение простых веществ: 4P + 5O2 → 2P2O5 4Al + 3O2 → 2Al2O3
Дополнение. С кислородом не взаимодействуют галогены, благородные газы, поэтому для получения оксидов этих элементов используют косвенные методы:
2HClO4 + P2O5 = Cl2O7 + 2HPO3 реакция проводится на холоду, т.к. оксид хлора (VII) термически неустойчивое вещество.
Азот реагирует с кислородом при 20000С, при этом образуется оксид азота (II). Для получения высшего оксида азота используют оксид фосфора (V): 2HNO3 + P2O5 = N2O5 + 2HPO3
Металлы взаимодействуют с кислородом так:

 Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
Металлы, расположенные в этой части ряда активности, окисляются кислородом. Не окисляются кислородом.
Особенности: 2Na+O2→Na2O2
2K+O2→K2O2(KO2)
3Fe+2O2→Fe3O4 (сгорание)
б) горение и обжиг сложных веществ:
CH4 + 2O2 → CO2 + 2H2O 2ZnS + 3O2 → 2ZnO + 2SO2
в) разложение сложных веществ:
- карбонатов (нерастворимых) BaCO3 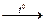 BaO + CO2
BaO + CO2
- сульфатов (кроме сульфатов натрия и калия) 2CuSO4 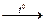 2CuO + 2SO2 + O2
2CuO + 2SO2 + O2
- Дополнение. Схема «Разложение нитратов»


 Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au
Нитраты щелочных Нитраты менее активных металлов (от щелочноземельных до меди) Нитраты наименее и щелочноземельных разлагаются до оксидов: 2Mg(NO3)2 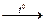 2MgO + 4NO2 + O2 активных металлов
2MgO + 4NO2 + O2 активных металлов
металлов разлагаются 2Cu(NO3)2 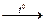 2CuO + 4NO2 + O2 разлагаются до металлов:
2CuO + 4NO2 + O2 разлагаются до металлов:
до нитритов: Hg(NO3)2 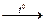 Hg + 2NO2 + O2
Hg + 2NO2 + O2
2NaNO3 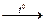 2NaNO2 + O2 2AgNO3
2NaNO2 + O2 2AgNO3 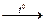 2Ag + 2NO2 + O2
2Ag + 2NO2 + O2
Исключения и дополнения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
2Fe(NO3)2=2Fe2O3 + 8NO2 + O2
NH4NO3 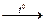 N2O + 2H2O NH4NO2
N2O + 2H2O NH4NO2 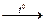 N2 + 2H2O
N2 + 2H2O
5). Химические свойства основных оксидов:






