- Просмотр
- What links here
Опубликовано lana в 2 мая, 2012 - 03:56
 (sciencephoto.com)
(sciencephoto.com)
Ученые из Исследовательского института Скриппса (The Scripps Research Institute) расшифровали сложный химический путь, позволяющий бактериям образовывать кластеры – так называемые биопленки. Это открытие в конечном итоге может способствовать разработке новых фармацевтических препаратов, мишенями которых являются биопленки, участвующие в развитии многих инфекций человека и помогающие бактериям успешно сопротивляться антибиотикам.
В статье, опубликованной он-лайн в журнале Molecular Cell, ученые из Исследовательского института Скриппса раскрыли, какую роль в образовании биопленок играет сигнальная молекула иммунной системы – оксид азота (NO).
«Считается, что на том или ином этапе своего жизненного цикла биопленки образуют около 80 процентов патогенов человека», – объясняет президент и исполнительный директор Института Скриппса Майкл Марлетта (Michael Marletta), PhD, возглавлявший исследование. «В этой работе мы впервые детализировали сигнальный путь от оксида азота к его сенсору, через клеточные регуляторы и далее до биологического результата – образования биопленок».
 Ларс Плейт (Lars Plate) – аспирант
Ларс Плейт (Lars Plate) – аспирант
лаборатории доктора Майкла Марлетты.
(Фото: The Scripps Research Institute)
Образование биопленки – результат слипания клеток бактерий друг с другом или их прикрепления к поверхностям. Этот феномен может быть и определенной стадией естественного роста бактерий, и их защитной реакцией. В таких скоплениях клетки на внешней поверхности биопленки остаются чувствительными к природным или фармацевтическим антибиотикам, но клетки, находящиеся внутри кластера, относительно защищены от их воздействия. Это затрудняет их уничтожение с помощью обычных методов лечения.
 Президент и исполнительный директор
Президент и исполнительный директор
Исследовательского института Скриппса
Майкл Марлетта (Michael Marletta), PhD.
(Фото: The Scripps Research Institute)
Биопленки могут образовываться на хирургических инструментах, таких как сердечные клапаны или катетеры, что приводит к развитию потенциально смертельных инфекций. Трудно устранимые биопленки играют ключевую роль в целом ряде болезней – от заболеваний десен до холеры и от муковисцидоза до болезни легионеров.
«Поиск путей воздействия на образование бактериальных биопленок сейчас представляет особый интерес», – подчеркивает ведущий автор статьи Ларс Плейт (Lars Plate), аспирант доктора Марлетты. «И необходимым условием для этого является понимание сигнального пути».
На протяжении многих лет лаборатория доктора Марлетты и другие исследовательские группы изучали, как оксид азота регулирует все – от расширения кровеносных сосудов до нервных сигналов – в организме человека и других позвоночных. Предыдущие исследования показали, что NO принимает участие и в образовании бактериальных биопленок.
В определенных количествах оксид азота токсичен для бактерий, поэтому логично, что он является триггером, запускающим развитие защитной реакции с их стороны – бактерии хотят «спрятаться» под биопленкой. Но до сих пор никто не знал точно, какова биохимия этого процесса.
В новом исследовании ученые поставили своей целью выяснить, что происходит после того, как курок спущен.
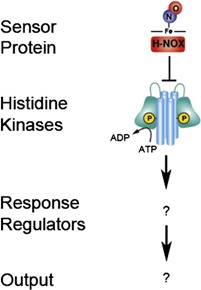
Сигналинг оксида азота у позвоночных хорошо изучен и включает в себя так называемый гем-оксид азота/кислород-связующий (Heme-Nitric Oxide/Oxygen, H-NOX) домен фермента гуанилатциклазы (guanylate cyclase) – селективный сенсор NO. Активируя этот фермент, NO запускает каскад химических реакций, ведущий к реализации физиологических функций, например, к расширению кровеносных сосудов.
У многих бактерии, в том числе и у основных патогенов, тоже есть белки Н-NOX, что представлялось ученым лучшей отправной точкой для исследований. Затем они обратилась к информации о геномах бактерий.
Гены взаимодействующих друг с другом белков часто расположены рядом. Исходя из этого факта, исследователи сделали вывод о связи между бактериальным H-NOX-связующим доменом и гистидинкиназой (histidine kinase) – ферментом, передающим фосфатные группы другим молекулам сигнального пути. Вопрос заключался в том, куда передаются фосфаты.
 (Рис. cell.com/molecular-cell)
(Рис. cell.com/molecular-cell)
Чтобы получить ответ на этот вопрос, ученые использовали метод, называемый анализом профиля передачи фосфатов (phosphotransfer profiling). Он включает в себя активацию гистидинкиназы, которая затем по отдельности реагирует с каждой из примерно 20 потенциальных мишеней. Мишени, которым гистидинкиназа быстро передает фосфатные группы, должны быть частью сигнального пути.
«Использованный нами метод очень точен, но ответ на вопрос оказался неожиданным», – комментирует Плейт.
Эксперименты показали, что гистидинкиназа фосфорилирует три белка, называемые регуляторами ответа, которые, работая вместе, контролируют образование биопленки у живущей в озерных отложениях бактерии Shewanella oneidensis – первого объекта исследований в этом проекте.
Дальнейшая работа показала, что каждый регулятор играет комплементарную роль, составляя вместе с двумя другими необычайно сложную систему. Первый регулятор активирует экспрессию генов, второй контролирует активность фермента, катализирующего синтез циклического дигуанозинмонофосфата (cyclic diguanosine monophosphate) – важной бактериальной молекулы-мессенджера, имеющей решающее значение в образовании биопленок, а третий настраивает степень активности второго.
Поскольку другие виды бактерий используют те же химические пути, эти данные проложат путь к дальнейшему изучению открывшихся возможностей в разработке фармацевтических препаратов. Например, можно блокировать образование биопленок химическими веществами, подавляющими активность одного из звеньев расшифрованного каскада реакций.
Группа доктора Марлетты уже изучила роль NO в развитии болезни легионеров и теперь планирует перейти к образованию биопленок бактериями, вызывающими холеру.






