Лекция №1
Основные понятия и законы химии. Закон сохранения массы, состава, газовые законы.
Главной задачей нефтедобывающей отрасли является максимальное извлечение углеводородов из недр с минимальными затратами. Для ее решения необходимо знание механизма протекающих в пласте физико-химических процессов между всеми его составляющими: коллекторами (это породы, обладающие пустотным пространством, проницаемостью, в которых возможно перемещение воды, нефти, газа под действием силы тяжести и перепада пластового давления), флюидами (нефть, газ, вода), закачиваемыми агентами воздействия на пласт в конкретных условиях. В настоящее время значительно расширен спектр химических составов для добычи нефти, большое внимание уделяется пониманию механизмов процессов, протекающих в пластовых условиях.
На нынешнем этапе развития отрасли, когда подавляющее число месторождений находится на поздних стадиях разработки, на 1 т добываемой нефти приходится большое количество попутных вод различной минерализации, ионного состава, значений рН, содержания агрессивных газов и механических примесей. Это в каждом конкретном случае требует дифференцированного подхода к проблемам выбора буровых растворов.
Вот почему в этом контексте воде и водным растворам электролитов мы будем уделять особое место. А сегодня мы начнем с темы:
Атомно-молекулярное учение. Атомы и молекулы. Относительная атомная и молекулярная масса. Моль – единица количества вещества. Молярная масса.
Атомно-молекулярное учение – это учение, в основу которого положено представление о том, что наименьшими структурными единицами веществ являются атомы, молекулы и ионы. Главные положения атомно-молекулярного учения были разработаны в середине XVIII – начале XIX в., благодаря работам М.Ломоносова 
Дж. Дальтона 
и др. ученых, хотя впервые представления об атоме возникли еще в древней Греции. Само слово “атом” древнегреческого происхождения и означает неделимый. “Молекула”, дословно, - маленькая масса.

Атомно-молекулярное учение окончательно было признано в 1860 г., когда на Международном съезде химиков в г. Карлсруэ (Германия) были приняты определения атома и молекулы. Атомы и молекулы обозначаются посредством химических формул.

Основные положения атомно-молекулярного учения:
1. Все вещества состоят из атомов, молекул и ионов.
а) Из атомов состоят:
- все металлы (Na, Ca, Fe, Cu и т.д.),
- многие неметаллы: инертные газы (He, Ne, Ar, Kr, Xe),
- С, Si, B, Se, As, Te.
б) Из молекул состоят:
- практически все органические вещества,
- небольшое число неорганических: простые вещества (H2, O2, N2, F2, Cl2, Br2, I2, P4, S8) и сложные вещества (NH3, CO, CO2, SO3, SO2, NO2, H2S, H2O, С2Н2 и др.).
в) Из ионов состоят:
- все соли (NaCl, CaSO4, K3PO4, MgCO3 и др.),
- многие основания (NaOH, KOH, NH4OH) и кислоты (HCl, H3PO4, H2SO4).
2. Атомы, молекулы и ионы находятся в непрерывном тепловом движении:
- в твердых веществах атомы, молекулы и ионы совершают колебательные движения относительно некоторых равновесных положений, называемых узлами кристаллической решетки;
- в жидкостях молекула, после некоторого числа колебаний в одном положении, совершает скачок в соседнее положение, где также совершает некоторое число колебаний и т.д.
- в газах молекулы совершают хаотическое движение по всему представленному объему.
3.Между атомами, молекулами и ионами имеются промежутки:
- в твердых веществах и жидкостях эти промежутки соизмеримы с размерами атомов и молекул;
- в газах расстояния между молекулами значительно превосходят размеры самих молекул.
4.Между атомами, молекулами и ионами существуют силы взаимного притяжения и отталкивания, имеющие электрическую природу. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей – в газах.
5. Простые вещества состоят из атомов или молекул, сложные – из молекул или ионов. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных – из различных.

6. Атомы химических элементов отличаются друг от друга зарядом ядра, массой, размерами и свойствами.
7. Молекула – более крупная структурная единица, чем атом. Она может содержать от двух до нескольких сотен тысяч атомов.
Структурные единицы веществ
Атом – наименьшая электронейтральная частица химического элемента и простого вещества, обладающая всеми его химическими свойствами и далее ни химически, ни физически неделимая.

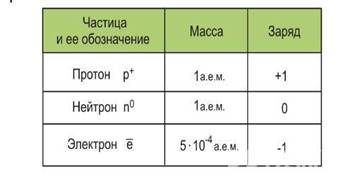
Электронейтральность атома обусловлена равенством числа электронов в электронной оболочке числу протонов в ядре. Т.к. заряды электрона и протона равны по величине и противоположны по знаку, то суммарный заряд атома равен нулю. Молекула, состоящая из электронейтральных атомов, также электронейтральна.
Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами и далее физически неделимая (но химически делимая).
Химические свойства атома обусловлены строением внешних (главным образом, последнего) энергетических уровней, химические свойства молекулы – ее составом и строением.
Физические свойства определяются совокупностью атомов или молекул. Бессмысленно говорить о физических свойствах, например, температуре кипения или температуре плавления отдельного атома или молекулы.
Массы и размеры атомов и молекул чрезвычайно малы.
Так, масса атома водорода m(H)=1,67•10-27 кг, диаметр – 1,06•10-10 м.
Ион –наименьшая частица сложного вещества, представляющая собой атом или группу атомов, которые отдали или присоединили один или несколько электронов и в результате чего приобрели избыточный положительный или отрицательный заряд.
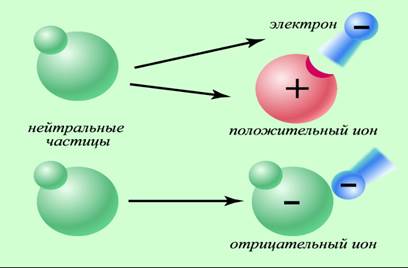
Например: Al0 – 3e- → Al3+,
S0 + 2e- → S2-
Абсолютная и относительная масса атомов и молекул
Масса атомов и молекул, выраженная в граммах или килограммах (г, кг), называется абсолютной (обозначается m).
На практике пользоваться абсолютными массами атомов и молекул часто оказывается неудобно, прежде всего из-за их величины (например, m(С)= 1,993•10-26 кг), поэтому, наряду с абсолютными, пользуются относительными массами атомов и молекул, т.е. массами определенными относительно 1/12 части массы атома углерода 12С, принятой за единицу и называемой атомной единицей массы (а.е.м.).
Абсолютная масса атомной единицы массы:
m(а.е.м.)= 1/12 m(С)=1/12•1,993•10-26кг = 1,66•10-27 кг= 1,66•10-24 г
Относительной атомной массой (Аr) (r – от «relative» - относительный) химического элемента называется число, показывающее во сколько раз данный атом тяжелее 1/12 части атома 12С.

Значение Аr приведены в таблице химических элементов Д.И.Менделеева.
Относительной молекулярной массой (Мr) вещества называется число, показывающее во сколько раз данная молекула тяжелее 1/12 атома 12С.

Из формул (1) и (2) следует, что Аr и Mr величины безразмерные.
Из формул (1) и (2) вытекает также связь между абсолютной и относительной массами атома и молекулы:
m(атома) = Ar • 1,66•10-27 кг
m(молекулы) = Мr • 1,66•10-27 кг
Масса молекулы равна сумме масс атомов, из которых молекула состоит
Мr = ∑ Ar
Например, Мr (О2) = 2 Ar (O) = 2•16=32,
Мr (H2O) = 2 Ar (H) + Ar (O) = 2•1 + 16=18,
Мr (Н2SO4) = 2 Ar (H) + Ar (S) + 4Ar (O) = 2•1+32+ 4•16=98.
При определении Мr ионных соединений (солей, кислот и щелочей) структурной единицей вещества условно считается молекула.
Относительная молекулярная масса кристаллогидрата:
Мr (кристаллогидрата)=Мr(безводной соли) +n Mr(H2O)
Например:
Мr(Na2SO4•10H2O) = Мr (Na2SO4) + 10•Мr(H2O) = 142 + 10•18 =322
При определении Мr кристаллогидратов структурной единицей вещества условно считается ассоциация, состоящая из одной молекулы соли и n молекул воды, связанных с ней.
Допускается также выражение относительной атомной и молекулярной масс в а.е.м.
Например:
Мr(O2) = 32 а.е.м., Мr(H2O) = 18 а.е.м., Мr(Н2SO4) = 98 а.е.м.
Ar - одна из основных характеристик химического элемента.
Мr - одна из основных характеристик вещества.
Количество вещества. Единица количества вещества.
Под количеством вещества (ν) понимают определенное число структурных единиц этого вещества. За единицу количества вещества принят 1 моль.
1 моль - количество вещества, содержащее столько же структурных единиц (атомов, молекул или других частиц), сколько их содержится в 12 г (0,012 кг) изотопа углерода 12С.
Т.к. масса 12С равна 1,993·10-23 г, то в 12 г углерода 12С содержится N = 12г/1,993·10-23 г = 6,02·1023 атомов.
Поэтому можно дать следующее определение моля:
Моль - это такое количество вещества, в котором, независимо от агрегатного состояния, содержится 6,02·1023 структурных единиц вещества.
Говоря о количестве вещества, всегда надо точно знать, из каких структурных единиц состоит вещество. Например:
· 1 моль железа – это 6,02•1023 атомов Fe, т.к. железо состоит из атомов.
· 1 моль воды – это 6,02•1023 молекул H2O, т.к. вода состоит из молекул.
· 1 моль хлорида натрия - это 6,02•1023 условных молекул NaCl (хлорид натрия состоит из ионов).
· 1 моль CuSO4•5H2O - это 6,02•1023 структурных единиц, каждая из которых состоит из одной условной молекулы CuSO4 и пяти молекул H2O.






