В периодах с повышением порядкового номера элемента, уменьшаются металлические свойства, следовательно, способность отдавать электроны также уменьшается, а присоединять увеличивается. Поэтому восстановительные свойства простых веществ снижаются, а окислительные - возрастают (максимальные у галогенов).
У элементов главных подгрупп с повышением порядкового номера увеличиваются металлические свойства (радиус атома возрастает, а состав последнего энергетического подуровня остается неизменным). Поэтому усиливаются восстановительные свойства и ослабляются окислительные.
Запомните!!!
1) Элементы в высшей степени окисления могут только восстанавливаться, например: S+6 (H2SO4), N+5 (HNO3 и нитраты), Mn+7,Cr+6; Pb+4 и прочие.
2) Элементы в низшей степени окисления могут только окисляться, например:
H2S-2; N-3H3.
3) Вещества в промежуточных степенях окисления могут быть и окислителями и восстановителями.
Важнейшие восстановители и окислители:
| Восстановители | Окислители |
| Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. | Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
4. Методика составления окислительно-восстановительных реакций. Влияние среды на направление и скорость окислительно-восстановительного процесса.
Для составления уравнений окислительно-восстановительных реакций необходимо знать окислительные и восстановительные свойства вступающих и образующихся в результате реакций соединений; они обычно устанавливаются экспериментально или на основе известных свойств элементов.
Необходимо учитывать, что:
· В окислительно-восстановительных реакциях формально происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарно числа электронов, теряемых восстановителем и обретаемых окислителем, равны;
· Для любого химического уравнения, общее количество одноимённых атомов в левой части равенства должно быть равно их количеству в правой части;
· Если реакции окисления-восстановления проходят в растворе, то необходимо учитывать влияние среды на стягивание освобождающихся ионов  с ионами
с ионами  (в кислой среде) с образованием слабо диссоциирующих молекул
(в кислой среде) с образованием слабо диссоциирующих молекул  , а в нейтральных и щелочных растворах они (ионы
, а в нейтральных и щелочных растворах они (ионы  ) регулируют с образованием гидроксил-ионов
) регулируют с образованием гидроксил-ионов  .
.
Применяются в основном в два метода составления уравнений окислительно-восстановительных реакций:
1) Метод электронного баланса, основаны на определении общего количества электронов, перемещающихся от восстановителя к окислителю,
2) ионно-электронный метод, предусматривающий раздельное составление ионных уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение. В данном методе следует найти не только коэффициенты для восстановителя и окислителя, но и для молекул среды. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может измениться.
В некоторых случаях реакция среды обуславливает даже изменение направление процесса.
Например:
 в щелочной среде
в щелочной среде


в кислой среде
в нейтральной и слабощелочной среде


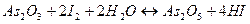
в кислой среде
При  перекись водорода является окислителем по отношению к элементарному йоду (образуется
перекись водорода является окислителем по отношению к элементарному йоду (образуется  ):
):

При  и более, наоборот,
и более, наоборот,  окисляется перекись водорода с выделением элементарного йода:
окисляется перекись водорода с выделением элементарного йода:

Регулируя среду, можно заставить реакцию количественно протекать в желательном направлении. Это изменение зависит также от концентрации реагирующих веществ.
Уравнения реакций окисления-восстановления мы будем изображать тремя последовательными стадиями:
1) Начальные продукты реакции,
2) Промежуточные продукты и их стяжение,
3) Конечные продукты реакции.
Для оформления второй стадии реакции следует знать правила стяжения.
Правила стяжения в реакциях окисления-восстановления
- Образующиеся в реакциях окисления-восстановления атомы с положительной степенью окисления 4+, 5+, 6+,7+ стягиваются с ионами кислорода и образуют остатки типа
 ,
,  .
.
Например:  и т.д.
и т.д.
Исключение:  в нейтральной или кислой среде образуют диоксиды
в нейтральной или кислой среде образуют диоксиды  .
.
Дополнение:
a) Амфотерные элементы с положительной степенью окисления 2+, 3+, 4+ в щелочной среде образуют гидроксокомплексы типа:
[Me (OH)4]2-, [Me (OH)6]3-, [Me (OH)6]2-
b) Элементы с положительной степенью окисления 1+, 2+, 3+ в кислой среде образуют соли.
2. Избыточные ионы кислорода (О2-) в кислой среде образуют (оттягиваются) с ионами Н+ малодиссоциированные молекулы воды:
О2- + 2Н+ =Н2О
- Избыточные ионы кислорода в нейтральной или щелочной среде стягиваются с ионами Н+ из молекул воды с образованием ионов гидроксила:
О2- + Н+ ОН- =ОН-
- Избыточные ионы водорода (Н+) в щелочной среде стягиваются с ионами ОН- с образованием молекул воды:
Н+ + ОН- =Н2О
- Недостающие ионы кислорода (О2-) в кислотной и нейтральной средах берутся из молекул воды с образованием ионов Н+:
Н2О - =2Н+ + О2-
- Недостающие ионы кислорода (О2-) в щелочной среде берутся из групп ОН- с образованием молекул Н2О:
2ОН- = Н2О+ О2-
VII. Недостающие ионы Н+ в щелочной среде берутся из молекул воды с образованием ионов гидроксила:
Н2О = ОН-+ Н+
а) Реакции окисления-восстановления в кислой среде
Разберём в качестве примера окисление сероводорода водным раствором марганцевого калия в кислой среде.
Реакция протекает в следующей схеме:
KMnO4 + Н2S + Н2SO4  K2S O4 + MnSO4 + S + Н2О
K2S O4 + MnSO4 + S + Н2О
В процессе реакции изменяется степень окисления марганца, входящего в состав иона MnO4-, и серы, входящей в состав малодиссоциированной молекулы Н2S, напишем ионно-электронные уравнения (1, 2), характеризующие процессы восстановления (MnO4-) и окисления (Н2О).
 2 MnO4- + 8Н- + 5e = Mn2+ + 4 Н2О (1)
2 MnO4- + 8Н- + 5e = Mn2+ + 4 Н2О (1)
5 Н2S – 2e = So + 2Н+ (2)
2MnO4- + 16Н+ + 5 Н2S = 2Mn2+ + 5S2- + 8Н2О + 1OH+ (3)
В правой и левой части каждого уравнения должны быть одинаковыми: числа атомов каждого элемента и алгебраическая сумма зарядов.
Рассматриваемая окислительно-восстановительная реакция протекает в кислой среде, поэтому для уравнивания числа атомов кислорода в левой части уравнения (1) написано 8 ионов водорода, в правой же части 4 молекулы воды. Количество ионов кислорода и водорода должны быть равны в обеих частях уравнения (1). Такое же уравнение числа атомов и алгебраической суммы зарядов произведено и в ионно-электронном уравнении, характеризующем процесс окисления сероводорода (2)
После уравнивания числа отданных и присоединённых электронов, пишется суммарное ионно-электронное уравнение (3) и на основании этих данных расставляются коэффициенты в уравнении реакции, написанном в молекулярном виде (4)
2MnO4- +5 Н2S + 3Н2SO4 = 2MnSO4 + 5S + K2SO4 + 8 Н2О






