Электрокинетические и оптические свойства коллоидных систем.
Явления относительного перемещения фаз вдоль поверхности распределения фаз, которые приводят к возникновению электрического поля, называются электрокинетическими.
Электрофорез - это явление перемещения частиц дисперсной фазы в электрическом поле к электроду, знак которого противоположный заряду частичек.
Электроосмос - это явление переноса жидкости (дисперсионной среды) сквозь диафрагмы под влиянием электрического тока.
Оптические свойства коллоидных растворов:
Опалесценция - золь имеет окраску. Поскольку наиболее сильно рассеиваются короткие волны, то рассеянный свет от источника белого света должнен иметь голубой оттенок. Т.е. золи в проходящем свете имеют одну окраску, а в отраженном - другую (голубую). Например, водный золь HgCl – красно-желтый, а в отраженном свете - голубой.
Эффект Фарадея-Тиндаля - рассеивание света коллоидными частицами. При пропуске сквозь золь пучка светы появляется светлый конус, который видно в затемненном помещении. Таким образом можно распознать, коллоидным или истинным является раствор.
***
При определенных условиях, например, при изменении условий сохранения (например, температуры), или при повышении концентрации золи переходят в гели - вязкие массы. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое - полутвердое состояние. При этом теряется текучесть, а вязкая масса заполняет весь объем, который занимал коллоидный раствор.
Гель удерживает очень большое количество дисперсионной среды, что вследствие ячеистой структуры проявляет качества твердого тела.
Много гелей под действием механических сил (встряхивание, перемешивание) переходят в золи. Обычно после завершения механического действия золь с большей или с меньшей скоростью переходит в гель. Это явление называется тиксотропией: гель ↔ золь.
Со временем гели претерпевают изменение - их структура постепенно уплотняется, выделяя частицу поглощенной жидкости. Это явление называется синерезисом. При высыхании геля его объем почти не изменяется.
От гелей следует отличать золи (студни) - растворы высокомолекулярных веществ в низкомолекулярных жидкостях (системы гомогенные). Они могут образоваться при набухании твердых полимеров в определенных жидкостях.
Значение золей исключительно большое, поскольку они более распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений - все это сложные золи.
С золями связано производство искусственных волокон, выделка кож, крашение, изготовление клея, пленок, чернила. Много золей в почве и от них зависит плодородность последних. Используются они и в строительстве.
Окислительно-восстановительные реакции.
Ключевые слова и понятия
Степень окисления
Окислительно-восстановительные реакции
Окисление
Восстановители
Восстановление
Окислители
Межмолекулярные окислительно-восстановительные реакции
Внутримолекулярные окислительно-восстановительные реакции
Реакции диспропорционирования
Структура темы:
1. Понятие об окислительно-восстановительных процессах.
2. Классификация окислительно-восстановительных процессов.
3. Зависимость окислительно-восстановительных свойств веществ в зависимости от положения атомов элементов в периодической системе Д.И.Менделеева. Важнейшие окислители и восстановители.
4. Методика составления окислительно-восстановительных реакций. Влияние среды на направление и скорость окислительно-восстановительного процесса.
1. Понятия об окислительно - восстановительных процессах.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление – один из важнейших процессов природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других биологических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателей внутреннего сгорания, электролитического осаждение металлов, процессы, происходящие в гальванических элементах в аккумуляторах, включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов (аммиака, щелочей, азотной, серной и других кислот) основано на окислительно-восстановительных реакциях.
С современной точки зрения процесс окисления-восстановления можно в общем случае рассматривать как перемещение электронов от одних частиц к другим. При этом происходит изменение степеней окисления соответствующих атомов или ионов.
Степень окисления(10.1) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные (2.9) элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например,
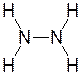
Степень окисления азота – -2; валентность азота – 3.
Для расчета степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме пероксидов, содержащих группу –O–O–, и F2-1O+2 в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Окислительно-восстановительные реакции (10.2) — это химические реакции, которые происходят с изменением степени окисление атомов, которые входят в состав реагирующих веществ. При этом любому веществу — окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2) — окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
ox1 + n e¯ = red1
red2 - n e¯ = ox2
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
ox1 + red2 = red1 + ox2
Окисление (10.3) — процесс отдачи электронов атомом, молекулой, или ионом. Атомы, молекулы или ионы, которые отдают электроны, называются в свою очередь восстановителями (10.4). Во время реакции они окисляются. При этом их степень окисления их повышается.
Восстановление (10.5) — процесс присоединения электронов атомом, молекулой, или ионом. Атомы, молекулы или ионы, которые присоединяют электроны, называются окислителями (10.6). Во время реакции они восстанавливаются. При этом их степень окисления понижается.






