Возьмите в сухую пробирку несколько кристаллов NH4Cl. Осторожно нагрейте пробирку, обратите внимание, как на холодных стенках пробирки осаждается белое вещество. Объясните это явление.
NH4Cl  NH3 + HCl ® NH4Cl¯
NH3 + HCl ® NH4Cl¯
Опыт 11. Окислительные и восстановительные свойства азотистой кислоты
Возьмите две пробирки. В одну налейте 1 мл иодида калия, а в другую - 1 мл раствора перманганата калия. В каждую пробирку добавьте по 1-2 мл раствора H2SO4 (2н), а затем 1-2 мл насыщенного раствора (или немного сухой соли) нитрита натрия. Что наблюдаете? Напишите уравнения реакций и объясните, какие свойства проявляет нитрит натрия в каждой из реакций.
KI + H2SO4 + NaNO2 ® I2¯ + NO + Na2SO4 + K2SO4 + H2O
KMnO4 + H2SO4 + NaNO2 ® MnSO4 + NaNO3 + K2SO4 + H2O
Опыт 12. Окислительные свойства азотной кислоты
Возьмите две пробирки. В одну пробирку поместите 1-2 кусочка меди, прибавьте 2-3 мл концентрированной азотной кислоты. Какой газ выделяется в этой реакции? Разбавьте раствор. Запишите наблюдения. В другую пробирку поместите кусочек цинка и налейте 1-2 мл концентрированной азотной кислоты. Запишите наблюдения. Разбавьте раствор. Что наблюдаете? Напишите уравнение реакции.
Cu + HNO3 (конц.) ® Cu(NO3)2 + NO2 + H2O
Cu + HNO3 (разб.) ® Cu(NO3)2 + NO + H2O
Zn + HNO3 (конц.) ® Zn(NO3)2 + N2O (NO2) + H2O
Zn + HNO3 (разб.) ® Zn(NO3)2 + N2 + H2O
Опыт 13. Получение оксида фосфора(V) и его свойства
В фарфоровую чашку возьмите несколько крупинок красного фосфора. Подожгите его нагретой стеклянной палочкой. Закройте горящий фосфор стеклянной воронкой и соберите образующийся оксид фосфора(V) в пробирку, надетую на конец воронки. Налейте в пробирку с оксидом фосфора(V) дистиллированной воды. Часть полученного раствора налейте в отдельную пробирку и добавьте в нее несколько капель метилоранжа. Метилоранж окрашивается в красный цвет. Какая реакция среды в пробирке? К другой части раствора оксида фосфора(V) в воде прилейте 2-3 капли раствора AgNO3. Обратите внимание на цвет осадка. Какая кислота получилась при растворении P2O5 в холодной воде? Напишите уравнение реакции.
Примечание: осадок метафосфата серебра имеет белую окраску, а осадок ортофосфата серебра - желтую окраску.
P2O5 + H2O ® 2HPO3 D2H+ + 2PO3-
HPO3 + AgNO3 ® AgPO3¯ + HNO3
HPO3 + H2O 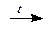 H3PO4
H3PO4
H3PO4 + 3AgNO3 ® Ag3PO4¯ + 3HNO3
Задачи и упражнения
1. Укажите возможные степени окисления следующих элементов: а) C; б) Si; в) Pb; г) N; д) P; е) As. Приведите примеры соответствующих соединений.
2. Какие свойства (основные, кислотные, окислительные, восстановительные) имеют соединения: а) N-3; б) N+3; в) N+5; г) C+4; д) P+5; е) Si-4. Напишите уравнения соответствующих реакций.
3. Напишите уравнения реакций:
C + Al 
| СaO + C 
|
CO2 + C 
| CaCO3 
|
Fe3O4 + CO 
| ZnO + C 
|
| CaCO3 + CO2 + H2O ® | CO2 + CaO ® |
| CaC2 + HCl ® | Al4C3 + H2O ® |
CO2 + Mg 
| CO2 + NaOH ® |
4. Напишите уравнения реакций:
Si + O2 
| Si + F2 ® |
| Si + NaOH + H2O ® | Si + HCl ® |
| SiO2 + Mg ® | Mg2Si + HCl ® |
| SiO2 + H2O ® | SiO2 + C 
|
SiO2 + Na2CO3 
| SiO2 + HF ® |
SiO2 + CaO 
| Na2SiO3 + H2O + CO2 ® |
| SiO2 + NaOH ® | SiH4 + O2 ® |
5. Напишите уравнения реакций:
Li + N2 
| N2 + H2 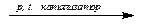
|
NH3 + O2 
| N2 + O2 
|
| NH3 + O2 ® | NO2 + H2O® |
| NO + O2 ® | NO2+ O2 + H2O ® |
| Cu + HNO3(разб.) ® | S + HNO3(конц.) ® |
| Ca + HNO3(оч.разб.) ® | Zn + HNO3(разб.) ® |
NaNO3 
| NH4NO3 
|
Zn(NO3)2 
| NH4NO2 
|
AgNO3 
| (NH4)2CO3 
|
6. Закончить уравнения реакций:
| P4 + O2(избыток) ® | P4 + O2(недостаток) ® |
P4 + Ca 
| Ca3P2 + H2O ® |
| PH3 + O2 ® | P4O10 + H2O ® |
HPO3 + H2O 
| P4O10 + H2O 
|
| Ca3(PO4)2 + H2SO4(избыток) ® | Ca3(PO4)2 + C + SiO2 
|
7. Напишите уравнения следующих превращений:
а) CO2 ® C ® CO ® CO2 ® CaCO3 ® Ca(HCO3)2 ® CO2
б) Si ® Mg2Si ® SiH4 ® SiO2 ® Na2SiO3 ® H2SiO3 ® SiO2
в) C ® CO2 ® K2CO3 ® CaCO3 ® CO2 ® Ca(HCO3)2 ® CaCO3 ® CO2
г) N2 ® NH3 ® NO ® NO2 ® HNO3 ® NH4NO3 ® N2O
д) P4 ® Ca3P2 ® PH3 ® P4O10 ® HPO3 ® H3PO4 ® Ca(H2PO4)2
е) NH4NO2 ® N2 ® NO ® NO2 ® HNO3 ® AgNO3 ® NO2
8. К 25,2 г остатка, полученного после прокаливания 50 г смеси карбоната кальция, фосфата кальция и карбоната аммония, добавили воду и пропустили избыток углекислого газа. Масса нерастворившегося осадка составила 14 г. Определите массу карбоната аммония в исходной смеси.
9. Смесь оксида углерода(II) и оксида углерода(IV) массой 13 г имеет объем 8,4 л (н.у.). Определите объем газа (н.у.) после пропускания смеси над раскаленным углем.
10. Имеется 4 г смеси кремния, алюминия и оксида магния. После обработки смеси избытком соляной кислоты выделилось 2,24 л газа (н.у.), а масса не растворившегося остатка составила 1,2 г. Определите количество вещества оксида магния в исходной смеси.
11. Смесь азота, оксида азота(II) и оксида азота(IV) объемом 82,4 мл пропустили через воду. Объем газов, не поглощенных водой, составил 50,4 мл. К ним добавили 16 мл кислорода. Объем газовой смеси после этого стал равен 56,1 мл. Определите объемную долю оксида азота(II) в исходной смеси. Объемы всех газов измерены при н.у.
12. Смесь азота и водорода объемом 99,2 л (н.у.) пропустили через катализатор. После установления равновесия смесь имела объем 76,8 л. Полученный аммиак растворили в 130 мл раствора аммиака с массовой долей 0,13 и плотностью 0,95 г/мл. Определите массовую долю полученного раствора.
13. При растворении в разбавленной азотной кислоте 6,08 г смеси порошкообразных железа и меди выделилось 1,792 л газа (н.у.). Определите массовые доли металлов в смеси.
14. Газ, полученный при разложении 425 г нитрата натрия, смешали в замкнутом сосуде с другим газом, образовавшимся при действии избытка раствора гидроксида калия на 45 г алюминия. Смесь газов взорвали. Определите массу полученного продукта.
15. При прокаливании 14,56 г смеси нитрата калия и нитрата натрия образовалось 12 г смеси твердых продуктов реакции. Определите массовые доли солей в исходной смеси.
Лабораторная работа 11
ЭЛЕМЕНТЫ VIA И VIIA ГРУПП
Теоретические вопросы
1. Электронное строение атомов элементов VIA и VIIA групп. Характерные степени окисления, примеры соединений в данных степенях окисления.
2. Валентности элементов VIA и VIIA групп. Особенности кислорода и фтора.
3. Изменение неметаллических свойств в группах и периодах на примере соединений VIA и VIIA групп.
4. Кислород. Озон. Пероксид водорода.
5. Сера. Сероводород. Сероводородная кислота. Оксиды серы. Сернистая кислота, сульфиты. Серная кислота, сульфаты.
6. Фтор. Фтороводородная кислота.
7. Хлор. Хлороводородная кислота. Оксиды хлора и кислородные кислоты хлора.
8. Бром, иод. Галогеноводородные кислоты, галогениды. Кислородные кислоты.
Экспериментальная часть






