Работа № 1. Растворимость спиртов и фенолов в воде.
Химизм реакции:
1.
С2Н5ОН + Н2О ® прозрачный раствор
этиловый спирт
2.
СН3 – СН(СН3) – СН2 - СН2 – ОН + Н2О ® мутный раствор
3-метилбутанол-1
3.
СН2(ОН) – СН(ОН) – СН2 – ОН + Н2О ® прозрачный раствор
глицерин
4.
С6Н5 – ОН + Н2О ® мутный раствор
фенол
НАБЛЮДЕНИЯ:
В пробирках с этиловым спиртом и глицерином образуется прозрачный раствор, а с изоамиловым спиртом и фенолом – наблюдается помутнение вследствие образования эмульсии.
ВЫВОДЫ:
Низкомолекулярные спирты, например этиловый спирт, хорошо растворяются в воде. Увеличение радикала, в случае изоамилового спирта, понижает их растворимость. В молекуле глицерина с увеличением числа гидроксильных групп растворимость возрастает.
Р а б о т а № 2. Отношение спиртов и фенолов к индикаторам.
Реактивы: лакмусовая бумажка синяя.
В пробирки с растворами этилового спирта, глицерина и фенола (работа 4). Опустите синюю лакмусовую бумажку. Цвет её не изменяется. Спирты можно считать нейтральными соединениями. Фенолы обладают кислым характером и в воде диссоциируют.
Химизм реакции:
Однако фенол очень слабая кислота, слабее угольной и поэтому не может изменить окраски лакмусовой бумажки.
Р а б о т а № 3. Взаимодействие глицерина с гидроксидом меди (II) в щелочной среде.
Реактивы: глицерин, 10% раствор гидроксида натрия, 2% раствор сульфата меди (12).
В пробирку внесите 2-3 капли раствора гидроксида натрия, 1 каплю сульфата меди, образуется голубой осадок гидроксида меди.
Химизм реакции:
Добавьте 1 каплю глицерина и встряхните. Осадок растворяется и появляется тёмно-синее окрашивание вследствие образования внутрикомплексного соединения глицерата меди.
Химизм реакции:
Соединение такого типа называют хелатными (от греч. хеле - клешня). Щелочной раствор глицерата меди применяется для открытия глюкозы в моче.
Р а б о т а № 4. Получение фенолята натрия и разложение его соляной кислотой.
Реактивы: 10% раствор гидроксида натрия, 7% раствор соляной кислоты (10).
К мутной эмульсии фенола в воде (работа 4) добавьте по каплям раствор щёлочи до образования прозрачного раствора фенолята натрия.
Химизм реакции:
В отличие от спиртов фенолы, обладая слабокислым характером могут образовывать феноляты не только при действии металлического натрия, но и водных растворов щелочей. К раствору добавьте несколько капель соляной кислоты до помутнения, вследствие выделения свободного фенола.
Химизм реакции:
Р а б о т а № 5. Окисление этилового спирта хромовой смесью.
Реактивы: этиловый спирт, хромовая смесь (18).
В сухую пробирку внесите 3 капли хромовой смеси и 1 каплю спирта. Слегка подогрейте. Оранжевый раствор становится зелёным и ощущается характерный запах уксусного альдегида.
Химизм реакции:
Р а б о т а № 6. Реакции фенола с хлоридом железа (III).
Реактивы: 1% раствор фенола, 1% раствор хлорида железа (III).
В пробирку внесите 2-3 капли раствора фенола и добавьте 1 каплю раствора хлорида железа (III). Появляется фиолетовое окрашивание. Фенолы дают с хлоридом железа различные окрашенные комплексы и поэтому эта реакция служит качественной реакцией для их открытия.
Р а б о т а № 7. Осаждение белка фенолом.
Реактивы: насыщенный водный раствор фенола (14), белок, водный раствор (3).
В пробирку внесите2-3 капли раствора фенола и добавьте 1 каплю раствора белка. Смесь мутнеет вследствие свёртывания белка фенолом. На этом основано применение фенола для дезинфекции.
Р а б о т а № 8. Получение диэтилового эфира.
Реактивы: этиловый спирт, серная кислота концентрированная.
В сухую пробирку внесите 2 капли этилового спирта и концентрированной серной кислоты. Осторожно нагрейте до незначительного побурения раствора. К горячей смеси добавьте ещё 2 капли этилового спирта. Образуется диэтиловый эфир с характерным запахом.
Химизм реакции:
Диэтиловый эфир применяется в медицине для наркоза. Однако для этой цели можно применять только особо чистый эфир так называемый эфир для наркоза.
Р а б о т а № 9. Окисление формальдегида гидроксидом меди (II).
Реактивы: 10% раствор формальдегида, 2% раствор сульфата меди (12), 10% раствор гидроксида натрия.
В пробирку внесите 3-4 капли раствора гидроксида натрия и 1 каплю раствора сульфата меди. К выпавшему осадку гидроксида меди добавьте 2-3 капли раствора формальдегида. Пробирку слегка подогрейте. Появляется осадок вначале жёлтый гидроксид меди (I), переходящий в красный оксид меди (I).
Химизм реакции:
Эта реакция является важной качественной реакцией на альдегидную группу.
Р а б о т а № 10. Осаждение белка формалином.
Реактивы: водный раствор белка (3), формалин (40% водный раствор формальдегида).
В пробирку внесите 3-4 капли раствора белка, затем 1-2 капли формалина и перемешайте. Происходи свёртывание белка под действием формалина. На этом свойстве основывают использование формалина для дезинфекции и консервирования (сохранения) анатомических препаратов.
Р а б о т а № 11. Цветная реакция на ацетон с нитропруссидом натрия.
Реактивы: 6% раствор нитропруссида натрия, 10% раствор гидроксида натрия, ацетон-водный раствор (1), 10% раствор уксусной кислоты (13).
В пробирку внесите 2-3 капли раствора нитропруссида натрия Na2/Fe(CN)5NO/, 1 каплю раствора ацетона и 1 каплю раствора гидроксида натрия. Появляется красное переходящее в оранжевое окрашивание. Добавьте 1-2 капли раствора уксусной кислоты. Появляется стойкое вишнёво-красное окрашивание.
Эта реакция применяется в клинической практике для открытия ацетона в моче (при сахарном диабете).
КОНТРОЛЬ
Оцениваемые компетенции:
1) Знания.
Методы контроля:
1) Тестирование или карт.контроль.
Вопросы
1) Спирттердің, фенолдың, тиол және аминдердің қышқылдық-негіздік қасиеттері.
The acid-base properties of alcohols, phenols, thiols, amines.
2) Реакции окисления
· первичных и вторичных спиртов;
· двухатомных фенолов;
· мягкое окисление тиолов;
· окисление альдегидов гидроксидами серебра и меди (II), Ag(NH3)2OH, реактивом Фелинга.
3) Образование простых эфиров и сложных эфиров с органическими и неорганическими кислотами.
4) Качественные реакции на многоатомные спирты, фенолы.
5) Реакции алкилирования, ацилирования аминов, тиолов. Ацилирующие агенты.
6) Дезаминирование первичных аминов.
7) Реакции восстановления альдегидов и кетонов.
8) Реакции, характерные для альдегидов и кетонов (с водой, спиртами, тиолами).
9) Реакции альдольного присоединения. Биологическое значение этой реакции.
Упражнения
1) Адреналин – гормон мозгового слоя надпочечников, норадреналин и дофамин являются предшественниками адреналина:



Дайте классификационную характеристику функциональным группам в этих соединениях и определите их кислотно-основной характер. По какой реакции можно получить адреналин из норадреналина. Напишите схему этой реакции.
2) Докажите кислотный характер пропанола-2, бензилового спирта, фенола, гидрохинона, этантиола. Какие из этих соединений проявляют свою кислотность при взаимодействии с гидроксидом натрия? Напишите реакции.
3) Напишите реакции окисления следующих соединений: 1) пропанола-2; 2) бензилового спирта; 3) гидрохинона; 4) метанола; 5) метантиола. Какая из этих реакций лежит в основе действия кофермента Q?
4) Как влияет природа радикала на основность следующих аминов: метиламин, метилэтиламин, анилина. Напишите реакцию образования солей этих соединений с хлороводородом.
5) Какие вещества используют для реакции альдольной конденсации, чтобы получить 3-гидрокси-2,2,4-триметилпентаналь?
6) Осуществите следующие превращения:
H2Сr2O7 Сu(OH)2, t C2H5OH,Н+
а) пропанол-1 А Б В
HNO2H2Сr2O7Ag(NH3)2OH, t CH3OH,Н+
б) этиламин А Б В С
C2H5OH,Н+ H2O,H+ H2Сr2O7Сu(OH)2, t
в) метаналь А Б В С
Назовите продукты.
Практическое занятие №11
Тема: Реакционная способность карбоновых кислот и их производных. Биологически важные классы гетерофункциональных соединений.
Цель:
1. Формировать навыки демонстрации химических свойств и качественных реакций на карбоновые кислоты для обнаружения их в растворах и навыки обоснования полученных результатов.
2. Научиться решать схемы реакции с гетерофункциональными соединениями, используя знания о химических свойствах гомофункциональных соединений.
Задачи обучения:
Обучающийся будет способен:
1) Сопоставлять реакционную способность карбоновых кислот в зависимости от их строения.
2) Писать взаимопревращения карбоновых кислот и их функциональный производных.
3) Изображать правильно формулу и давать название по международной и рациональной номенклатурам основных представителей гетерофункциональных органических соединений.
4) Определять в молекуле по наличию функциональных групп химические свойства гетерофункциональных соединений.
5) Выбирать эффективный способ решения ситуационных задач, предложенных преподавателем.
Основные вопросы темы:
1) Химические свойства карбоновых кислот.
2) Строение и номенклатура гетерофункциональных соединений: аминоспирты, гидроксикислоты, альдегидо- и кетокислоты.
3) Химические свойства по фукциональным группам гетерофукциональных соединений.
4) Гетерофункциональные органические соединения бензольного ряда.
Методы обучения и преподавания:
Метод - комбинированный:
1) комбинированный опрос (устный опрос, работа в малых группах, письменный опрос).
2) проверка домашнего задания.
Средства обучения: учебные таблицы, рисунки по теме, тестовые задания или билеты.
Работа в малых группах:
Студенты делятся на три группы, каждой группе дается задание по лабораторной работе, предложенные преподавателем.
Перед выполнением задания со студентами на устном опросе разбирается тема занятия.
Задания обсуждаются в малых группах, а затем ответ озвучивается одним из студентов. Группа, выполнившая все задания по лабораторной работе, считается лучшей. Во время обсуждения преподавать контролирует и корректирует работу студентов.
Литература:
Основная:
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия [Текст]: Учебник /.- Изд.5-е, стереотип. - М.: Дрофа, 2006.- с. 179-181, 194-207, 233-277.
2. Под ред.проф. Н.А. Тюкавкиной. Биоорганическая химия: руководство к практическим занятиям [Текст]: Учебное пособие.- М.: ГОЭТАР-МЕДИА, 2012.-168 с.
Дополнительная:
1. Алмабекова, А.А. Сборник заданий в тестовой форме по органической химии. [Текст]: учебное пособие. / А.А. Алмабекова.- Алматы.: Эверо, 2009.- 306 с.
Вспомогательная:
1. Асанбаева, Р.Д. Учебно-методическое пособие биоорганической химии для самостоятельной работы студ-в 1 курса лечебного, педиатр., сан.-гигиенич., стоматол. фак-в [Текст]: Ч.1. / Р.Д. Асанбаева; КазНМУ им. С.Д.Асфендиярова.- Алматы, 2004.- 128с.
На английском языке:
1. Morris Hein, Scott Pattison, Susan Arena. Introduction to General, Organic, and Biochemistry [Text]: Book / 10th Edition.-USA: John Wiley&Sons, Inc, 2012.-1091 p.
Лабораторные работы:
Студенты оформляют протоколы (пишут химизм реакции, наблюдения и основные выводы). Преподаватель контролирует работу студентов для того, чтобы научить их практическим навыкам.
Р а б о т а № 1. Диссоциация щавелевой и уксусной кислот.
Реактивы: 10% раствор уксусной кислоты (13), щавелевая кислота, лакмусовая бумажка.
В одну пробирку внесите 2-3 капли уксусной кислоты, в другую несколько кристаллов щавелевой кислоты. Добавьте в каждую пробирку по 5 капель воды и встряхните. Реакцию растворов испытайте на лакмус и запишите схему диссоциации кислот.
Р а б о т а № 2. Окисление муравьинной кислоты перманганатом калия.
Реактивы: перманганат калия, 10% раствор серной кислоты (3), баритовая вода (2), формиат натрия.
В пробирку внесите несколько крупинок формиата натрия, прибавьте 3 капли серной кислоты и 2 капли раствора перманганата калия. Плотно закройте пробирку пробкой с газоотводной трубкой, нижний конец которой поместите в пробирку с 4-5 каплями баритовой воды, пробирку нагрейте. Какие изменения наблюдаются в обеих пробирках? Запишите схему окисления муравьиной кислоты перманганатом калия.
Р а б о т а № 14. Устойчивость уксусной кислоты к окислителям.
Реактивы: 10% раствор уксусной кислоты (13), 0,5% раствор перманганата калия, 10% раствор серной кислоты (9).
В пробирку внесите 2-3 капли уксусной кислоты и добавьте по 2-3 капли воды, перманганата калия и серной кислоты, содержимое пробирки перемешайте. Что наблюдается? Сделайте вывод об отношении муравьиной и уксусной кислот к окислителям.
Химизм реакции:
При поджигании газ горит голубоватым пламенем. С помощью этой реакции можно отличить муравьиную кислоту от уксусной, которая не даёт такой реакции.
Р а б о т а № 3. ОТКРЫТИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ В ВИДЕ КАЛЬЦИЕВОЙ СОЛИ.
Реактивы: 1% раствор щавелевой кислоты, 5% раствор хлорида кальция (16).
В пробирку поместите 2-3 капли раствора щавелевой кислоты и добавьте 1 каплю раствора хлорида кальция. Выпадает белый осадок оксалата кальция.
Химизм реакции:
Кристаллы оксалата кальция иногда обнаруживаются при клиническом исследовании мочи.
Р А Б О Т А № 4. ПОЛУЧЕНИЕ УКСУСНО-ЭТИЛОВОГО ЭФИРА (ЭТИЛАЦЕТАТА)
Реактивы: безводный ацетат натрия, этиловый спирт, концентрированная серная кислота.
В сухую пробирку поместите немного (высота слоя около 2мм) порошка ацетата натрия и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте. Через несколько секунд появляется характерный освежающий запах уксусно-этилового эфира.
Химизм реакции:
Реакция этерификации в присутствии сильной минеральной кислоты (Н2SО4) служащей катализатором, идёт по механизму нуклеофильного замещения (SN).
КОНТРОЛЬ
Оцениваемые компетенции:
1) Знания.
Методы контроля:
1) Тестирование или карт.контроль.
Вопросы
1) Образование солей моно- и дикарбоновых кислот.
2) Образование сложных эфиров и сложных тиоэфиров. Биологическое значение тиоэфиров карбоновых кислот. Ацетилкофермент А.
3) Реакции образования амидов и ангидридов карбоновых кислот. Смешанные ацилфосфаты как метаболиты.
4) Дикарбон қышқылдарының химиялық қасиеттері: декарбоксилдеу және сақиналы ангидридтердің түзілуі.Сhemical properties of dicarboxylic acids: dicarboxylation and the formation of cyclic anhydrides.
5) Аминоспирты: этаноламин, холин, ацетилхолин. Понятие о биогенных аминах. Дофамин, норадреналин, адреналин, их биологическое значение как гормонов и нейромедиаторов.
6) Гидроксикислоты: гликолевая, молочная, яблочная, винная и лимонная кислоты.
7) Альдегидо- и кетокислоты: глиоксиловая, пировиноградная, ацетоуксусная, щавелевоуксусная, α- кетоглутаровая кислоты - важнейшие метаболиты.
8) Реакции гидроксикислот и оксокислот за счёт:
а) карбоксильной группы: 1) образование солей; 2) образование сложных эфиров; 3) образование амидов; 4) декарбоксилирование
б) гидроксильной группы: 1) образование солей; 2) окисление; 3) образование простых и сложных эфиров.
в) карбонильной группы: реакция восстановления.
9) Кето-енольная таутомерия на примере ацетоуксусного эфира. Доказательство енольной формы.
10) Гетерофункциональные органические соединения бензольного ряда. Салициловая кислота и ее производные. п-Аминобензойная кислота. Новокаин, анестезин – анестетики. п-Аминофенол и его производные - парацетамол и фенацетин как анальгетики.
Упражнения
1. Напишите реакции, идущие по следующей схеме:
Уксусная кислота + НSКоА® А + Н2О
Малоновая кислота + НSКоА® В + Н2О
А + В 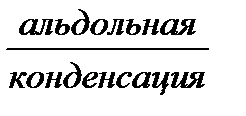 В
В 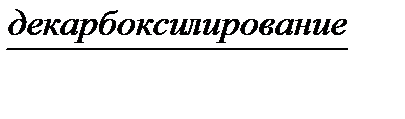 Г
Г
Объясните биологическое значение этих реакций.
2. Объясните, почему щавелевая и малоновая кислоты при нагревании декарбоксилируются, а не образуют ангидриды. Напишите реакции.
3. Напишите реакции по следующей схеме: этаноламин ®холин ® ацетилхолин.
4. Напишите реакцию окисления молочной и b-гидроксимасляной кислот. Назовите полученные продукты реакции.
5. Напишите реакции восстановления глиоксиловой и пировиноградной кислот, используя НАДН.
6. Какая из таутомерных форм ацетоуксусной кислоты (3-оксобутановая кислота) взаимодействует с бромной водой? Напишите реакцию.
7. Напишите реакцию по типу альдольной конденсации щавелевоуксусной (оксобутандиовой) кислоты и ацетилкофермента А.
8. Напишите реакции следующих превращений: фумаровая кислота®яблочная кислота®щавелевоуксусная (оксобутандиовая) кислота.
9. Отношение салициловой кислоты к нагреванию, реакция образования ацетилсалициловой кислоты. Написать соответствующие реакции. За счет каких функциональных групп идут эти реакции?
Практическое занятие №12
Тема: Биологически важные свойства α-аминокислот. Пептиды. Качественные реакции на пептиды и белки.
Цель:
1. Научиться применять знания о закономерностях строения, классификации и химических свойств α-аминокислот при построении пептидов.
2. Формировать навыки демонстрации химических свойств и качественных реакций на пептиды и белки для обнаружения их в растворах и навыки обоснования полученных результатов.
Задачи обучения:
Обучающийся будет способен:
1) Сопоставлять реакционную способность α-аминокислот в зависимости от их строения.
2) Делать выводы по результатам качественных реакций на α-аминокислоты, пептиды, белки, используя знания о химических свойствах α-аминокислот.
3) Изображать схему построения пептидов из α-аминокислот, предложенных преподавателем.
4) Определять заряд белковой молекулы в зависимости от рН среды, зная значения изоэлектрической точки α-аминокислот.
Основные вопросы темы:
1) Изоэлектрическая точка α-аминокислот. Электрофорез, как метод разделения α-аминокислот.
2) Химические свойства аминокислот как бифункциональных соединений.
3) Специфические реакции a- аминокислот.
4) Образование пептидов. Кислотный и щелочной гидролиз пептидов.
5) Качественные реакции.
Методы обучения и преподавания:
1. Метод - комбинированный:
a)комбинированный опрос (устный опрос, работа в малых группах, письменный опрос).
б)проверка домашнего задания.
2. Игровой метод обучения
3. Метод TBL
Работа в малых группах:
Студенты делятся на три группы, каждой группе дается задание по лабораторной работе, предложенные преподавателем.
Перед выполнением задания со студентами на устном опросе разбирается тема занятия.
Задания обсуждаются в малых группах, а затем ответ озвучивается одним из студентов. Группа, выполнившая все задания по лабораторной работе, считается лучшей. Во время обсуждения преподавать контролирует и корректирует работу студентов.
Литература:
Основная:
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия [Текст]: Учебник /.- Изд.5-е, стереотип. - М.: Дрофа, 2006.- с.314-344.
2. Под ред.проф. Н.А. Тюкавкиной. Биоорганическая химия: руководство к практическим занятиям [Текст]: Учебное пособие.- М.: ГОЭТАР-МЕДИА, 2012.-168 с.
Дополнительная:
1. Алмабекова, А.А. Сборник заданий в тестовой форме по органической химии. [Текст]: учебное пособие. / А.А. Алмабекова.- Алматы.: Эверо, 2009.- 306 с.
Вспомогательная:
1. Асанбаева, Р.Д. Учебно-методическое пособие биоорганической химии для самостоятельной работы студ-в 1 курса лечебного, педиатр., сан.-гигиенич., стоматол. фак-в [Текст]: Ч.1. / Р.Д. Асанбаева; КазНМУ им. С.Д.Асфендиярова.- Алматы, 2004.- 128с.
На английском языке:
1. Morris Hein, Scott Pattison, Susan Arena. Introduction to General, Organic, and Biochemistry [Text]: Book / 10th Edition.-USA: John Wiley&Sons, Inc, 2012.-1091 p.
Лабораторные работы:
Студенты оформляют протоколы (пишут химизм реакции, наблюдения и основные выводы). Преподаватель контролирует работу студентов для того, чтобы научить их практическим навыкам.
Р А Б О Т А № 1. БИУРЕТОВАЯ РЕАКЦИЯ.
Реактивы: белок (3), 10% раствор гидроксида натрия, 2% раствор сульфата меди.
В пробирку поместите 5 капель раствора белка, 3 капли гидроксида натрия и 1 каплю сульфата меди. После взбалтывания появляется фиолетовое окрашивание.
В щелочной среде, находящиеся в белке пептидные связи, реагируя с сульфатом меди, образуют окрашенные медные солеобразные комплексы. Окраска этих комплексов, а следовательно, и жидкости зависит от количества пептидных связей. Промежуточные продукты гидролиза белков – полипептиды, имеющие в своём составе по сравнению с белком меньше пептидных связей, дают фиолетово-розовую или розовую окраску. Данная реакция является общей реакцией на белки. Она указывает на наличие в молекуле белка пептидных связей. Биуретовую реакцию дают также некоторые небелковые вещества, имеющие в своей молекуле не менее двух указанных выше связей.
Р А Б О Т А № 2. НИНГИДРИНОВАЯ РЕАКЦИЯ.
Реактивы: белок, 0,1% раствор нингидрина.
В пробирку поместите 5 капель раствора белка и 3 капли раствора нингидрина, нагрейте. Через 2-3 минуты жидкость окрашивается в синий цвет. Реакция обусловлена наличием в белке остатков a-аминокислот. При нагревании белка с водным раствором нингидрина происходит реакция между аминокислотами, содержащими свободную a-аминогруппу, и нингидрином. В результате реакции образуются аммиак, углекислый газ, соответствующий альдегид и восстановленный нингидрин. Последний с аммиаком и второй молекулой нингидрина образует окрашенный в синий цвет продукт конденсации.
КОНТРОЛЬ
Оцениваемые компетенции:
1) Знания.
2) Практические навыки.
Методы контроля:
1) Проверка выполнения упражнений.
2) Тестирование или карт.контроль.
Вопросы
1) α-Амин қышқылдарының қышқылдық-негіздік қасиеттері.
The acid-base properties of α-aminoacids.
2) Изоэлектрическая точка α-аминокислот. Электрофорез, как метод разделения α-аминокислот.
3) Химические свойства аминокислот как бифункциональных соединений.
Реакции -СООН группы:
а) образование амидов на примере аспарагиновой, глутаминовой кислот.
б) декарбоксилирование триптофана и гистидина.
4) Реакции -SH группы:
а) мягкое окисление цистеина. Биологическая роль данной реакции.
б) жёсткое окисление цистеина с последующим декарбоксилированием.
Обратить внимание студентов на реакции декарбоксилирования, приводящие к образованию биогенных аминов; на реакции образования дисульфидной связи.
5) Реакции -NH2группы:
1) дезаминирование:
а) неокислительное;
б) окислительное;
в) гидроксилирование.
2) образование соли с НСI на примере метиламина, аланина.
6) Реакции -ОН группы:
а) окисление;
б) образование сложных эфиров.
7) Гидролиз аргинина.
8) Специфические реакции a- аминокислот:
а) образование биполярного иона;
б) образование пептидов. Номенклатура. Электронное и пространственное строение пептидной группы.
9) Написать трипептид глутатион. Значение.
10) Кислотный и щелочной гидролиз пептидов.
11) Качественные реакции: ксантопротеиновая, нингидриновая, биуретовая.
Упражнения
1. Напишите схемы реакции аланина с а) СН3I, б) NaOH, в) HNO2, г) этанолом. Назовите продукты.
2. Напишите реакции дезаминирования изолейцина, глутаминовой кислоты.
3. Реакция образования трипептидов: 1) Цис-Вал-Асп; 2) Гли-Про-Лиз. Определить кислотно-основный характер трипептидов.
4. Напишите кислотно-щелочной гидролиз трипептида, например Гли-Вал-Фен (глицилвалилаланина).
5. Напишите реакцию образования трипептида глутатиона (¡-Глу-Цис-Гли). Биологическое значение.
6. Приведите строение нейропептида головного мозга Leu-энкефалина с аминокислотной последовательностью Tyr-Gly-Gly-Phe-Leu. Какие продукты образуются в результате полного гидролиза этого пептида в среде хлороводородной кислоты?
7. Почему после приема глутаминовой кислоты в виде порошка рекомендуется прополоскать рот слабым раствором гидрокарбоната натрия (рН~8), если известно, что значение изоэлектрической точки глутаминовой кислоты равно 3,2?
Практическое занятие №13
Тема: Особенности физико-химических свойств растворов биополимеров. Общие свойства белков. Экспериментальное изучение кинетики набухания высокомолекулярных веществ.
Цель:
1. Научиться объяснять физико-химические свойства растворов ВМС в зависимости от строения макромолекулы.
2. Формировать практические навыки изучения кинетики набухания полимера и определения изоэлектрической точки белка.
задачи обучения:
Обучающийся будет способен:
1) Перечислять различные типы ВМС и объяснять основные свойства белков и растворов биополимеров.
2) Описывать основные процессы, сопровождающиеся нарушением устойчивости растворов белков.
3) Давать определение и пояснять физико-химическую сущность и биологическую роль процессов денатурации, высаливания, коацервации, синерезиса, тиксотропии.
4) Демонстрировать экспериментальное определение степени набухания полимера и строить кинетические кривые набухания.
5) Определять экспериментально изоэлектрическую точку белка по величине степени его набухания и делать выводы по результаты эксперимента.
Основные вопросы темы:
1) Биополимеры живого организма. Белки – полиамфолиты.
2) Набухание ВМС. Зависимость набухания от различных факторов.
3) Растворы ВМС. Устойчивость растворов биополимеров. Факторы, нарушающие устойчивость растворов ВМС.
4) Осмотическое давление растворов ВМС. Онкотическое давление плазмы крови.






