Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой самодиссоциацией воды на ионы водорода и гидроксид-ионы.

или

Данное равновесие можно описать соответствующей константой диссоциации:

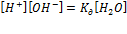

Kw – ионное произведение воды.
Kw= 10–14
При диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов должны быть одинаковы: [H+] = [ОН–]. Используя значение ионного произведения воды, находим

Такова концентрация ионов Н+ и ОН– в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота – сильный электролит, диссоциирующий в воде на ионы H+ и Сl–. Следовательно, концентрация ионов Н+ в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении [Н+] должна уменьшаться [ОН–].Напротив, если к воде добавить щелочь, то концентрация[ОН–] увеличится, а[Н+] уменьшится. Таким образом, концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+] < 10-7 моль/л.
рН раствора. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН:
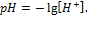
Кроме него пользуются показателем pOH:

Для чистой воды [Н+] = [ОН-] = 10-7 и рН = рОН = 7. Это нейтральная среда и нейтральные растворы. Если в растворе [Н+] > [ОН-], то рН < 7, а рОН > 7 - это кислые растворы; в случае если [Н+] < [ОН-], то рН > 7, а рОН < 7 - это щелочные растворы. Очевидно, что

Концентрации ионов Н+ и ОН-, кислотность и щелочность растворов определяют либо с помощью химических индикаторов - органических веществ, которые изменяют свою окраску в определенном интервале рН, либо с помощью специальных приборов - рН-метров. Например, лакмус имеет красную окраску при рН < 5, а синюю - при рН > 8; от 5 до 8 - диапазон перехода рН. В таблице приведены характеристики наиболее часто встречающихся индикаторов:
| Индикатор | Интервал перехода рН | Окраска | |
| в кислой среде | в щелочной среде | ||
| Лакмус | 5 ¸ 8 | красная | синяя |
| Фенолфталеин | 8,3 ¸ 10,0 | бесцветная | красная |
| Метиловый фиолетовый | 0 ¸ 3 | желто-зеленая | фиолетово-голубая |
| Метиловый оранжевый | 3,1 ¸ 4,4 | красная | желтая |






