
Согласно классификации гетерофункциональних карбоновых кислот яблочная кислота является:
A. трехосновной трехатомной кислотой;
B. двуосновной двуатомной кислотой;
C. двуосновной трехатомной кислотой;
D. трехосновной двуатомной кислотой;
E. одноосновной трехатомной кислотой;
2. Подберите подходящее название для фенолокислоти:

A. Пирогалловая кислота
B. Галловая кислота
C. Салициловая кислота
D. Фрологлюциновая кислота
E. Оксигидрохиноновая кислота
3. Какая из предложенных реакций приводит к образованию салициловой кислоты?
A. 
B. 
C. 
D. 
Гидролизом 2,2-дихлорпропановои кислоты получают оксикислоты. Определить полученную кислоту.
A. Щавелевоуксусная
B. Пировиноградная
C. Ацетоуксусная
D. 2-кетоглутаровая
E. 2-оксобутановая
5.Выберите последовательность, в которой увеличиваются кислотные свойства в ряду:



1 2 3
A. 2; 3; 1
B. 1; 3; 2
C. 3; 2; 1
D. 3; 1; 2
E. 2; 1; 3
Опираясь на знание рКа укажите какая из приведенных ниже кислот является сильнейшей.
A. Хлороуксусная кислота (рКа=2,85);
B. Фтороуксусная кислота (рКа=2,57);
C. Трихлороуксусная кислота (рКа=0,66);
D. Бромоуксусная кислота (рКа=2,90);
E. Йодоуксусная кислота (рКа=3,16);
7. В п-амино салициловой кислоте карбоксильная группа проявляет такие электронные эффекты:

A. –І, +М
B. –І, –М
C. Только –І
D. +І, –М
E. +І, +М
Структурная формула п-аминобензойной кислоты.

Выберите реагент, который вступает в реакцию с аминогруппой.
A. NaOH;
B. NaHCO3;
C. (CH3CO)2O;
D. SOCl2;
E. PCl3
9. С каким из приведенных реагентов салициловая кислота реагирует только по карбоксильной группе?

A. Н2;
B. NaHCO3;
C. (CH3CO)2O;
D. FeCl3;
E. NaOH
10. a-Гидроксикислоты при нагревании образуют:
A. Ненасыщенные α, β- кислоты
B. Эфиры с открытой цепью
C. Ацетоуксусный эфир
D. Лактоны
E. Лактиди
11. Укажите соединение, образующееся при взаимодействии молочной кислоты с избытком SOCl2




A BC
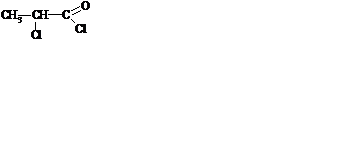

DE
12. В результате кислотного расщепления 2-этилацетоуксусного эфира (рисунок) образуются:

A. Этановая кислота, Этанол
B. Метановая кислота, пропановая кислота, этанол
C. Этановая кислота, пропановая кислота, этанол
D. Метановая кислота, бутановяа кислота, этанол
E. Этановая кислота, бутановая кислота, этанол.
13. Из приведенных веществ при добавлении в раствор FeCl3 дает темно фиолетовый цвет?
A. Бензол
B. Салициловая кислота
C. Толуол
D. Ацетилсалициловая кислота
E. Бензойна кислота
14. Для распознавания фенола и салициловой кислоты используем реагент:
A. Раствор натрия гидрокарбонат
B. Раствор железо хлорида (iii)
C. Раствор натрия гидроксида
D. Раствор натрия хлорида
E. Раствор брома
Эталоны ответов:
1.C, 2.В, 3.D, 4.В, 5.А, 6.С, 7.В, 8.С, 9.В, 10.Е, 11.D, 12.Е, 13.В, 14.А.
Тема №20
Производные угольной кислоты
АктуальнОсть темЫ
Угольная кислота относится к классу двухосновных кислот и образует два ряда функциональных производных - неполные и полные галогенангидриды, сложные эфиры, амиды, а также смешанные функциональные производные - эфиры хлорвугильнои кислоты, эфиры карбаминовой кислоты и др.
Производные угольной кислоты широко применяются в фармацевтическом синтезе и в медицинской практике как лекарственные препараты. Например, некоторые уретаны обладают снотворным и транквилизирующее действие, а структура циклического уреиды малоновой кислоты лежит в основе барбитуратов, гуанидин является структурным фрагментом биологически соединений (аргинин, стрептидина).
Умение интерпретировать химическое строение и свойства производных угольной кислоты необходимы студенту фармацевтического факультета для изучения таких дисциплин, как фармацевтическая химия, токсикологична химия, фармакология, фармакогнозия. Они позволяют спрогнозировать изменения, которые происходят при хранении лекарств, понять взаимосвязь между их строением и действием на организм, разрабатывать новые методы синтеза лекарственных веществ.
Вам нужно ознакомиться с целями занятия и обдумать их, осознать необходимость изучения этой темы.
ЦЕЛИ ОБУЧЕНИЯ
Общая цель: Уметь интерпретировать химические свойства производных угольной кислоты для использования в фармацевтической химии, фармацевтическом и токсикологическом анализе.
Конкретные цели
Уметь:
1. Описывать способы добывания производных угольной кислоты;
2. Интерпретировать электронное строение производных угольной кислоты;
3. Составлять химические реакции с участием производных угольной кислоты;
СОДЕРЖАНИЕ ОБУЧЕНИЯ
1. Основные теоретические вопросы:
1. Классификация и номенклатура производных угольной кислоты.
2. хлорангидрида угольной кислоты. Способы добычи и химические свойства.
3. Эфиры угольной кислоты.
4. Амиды угольной кислоты.
5. Мочевина.
6. Способы идентификации производных угольной кислоты. Значение производных угольной кислоты в качестве лекарственных веществ.
2. Основные термины и их определения
Карбонатная (угольная) кислота - неустойчивое соединение, которое легко распадается на оксид углерода (IV) и воду.
Угольная кислота как двухосновная образует два ряда функциональних производных - неполные и полные галогенангидриды, сложные эфиры, амиды, а также смешанные функциональные производные - эфиры хлоругольной кислоты, эфиры карбаминовой кислоты (уретаны) и др.
Эфиры карбаминовой кислоты называют уретаны. Уретаны получают действием аммиака на эфиры хлоругольной кислоты или диэфиры угольной кислоты:
Уретаны - бесцветные кристаллические вещества, проявляющие свойства амидов и эфиров. В поисках центральных миорелаксантов был синтезирован мепротан (мепробамат), который принято считать родоначальником малых транквилизаторов. Имеет снотворное и транквилизирующее действия.
Мочевина - конечный продукт распада белков, содержится в моче человека (около 2%), откуда и была впервые выделена. В промышленности мочевину получают в больших количествах взаимодействием аммиака с оксидом углерода (IV)
Мочевина - белое кристаллическое вещество (т.пл. 133 ° С), хорошо растворяется в воде. В химическом отношении проявляет свойства амидов. С сильными кислотами мочевина образует соли. Так, при воздействии на мочевину азотной кислоты образуется мало растворимый в воде нитрат мочевины:
Под действием азотной кислоты мочевина разлагается с выделением азота, оксида углерода(IV) и воды. Эта реакция может использоваться для количественного определения мочевины измерением объема выделившегося азота:
При медленном нагревании кристаллического вещества до 150-160 ° С образуется биурет:
Граф логической структуры
ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
Галогенангидриды
Амиды
Хлоругольная к-та
Фосген
Мочевина
Карбаминовая
к-та
Эфиры хлоругольной кислоты
Уреиды
Уретаны
СПОСОБЫ ПОЛУЧЕНИЯ
ХИМИЧЕСКИЕ СВОЙСТВА
ИДЕНТИФИКАЦИЯ
ИСПОЛЬЗОВАНИЕ В ФАРМАЦЕВТИЧЕСКОЙ ПРАКТИКЕ
4. Источники информации
1. Черных, В. П. Органическая химия: в 3–х кн. Кн.2. Углеводороды и их функциональные производные: учебник для фармац. вузов и фак. / В. П. Черных, Б. С. Зименковский, И. С. Гриценко. – Х.: Основа, 1993, с. 468-476.
2. Лекции по органической химии В. П. Черных: Учеб. пособие для студ. вузов. – Х.: Издательство НФаУ: Золотые страницы, 2005, с. 320-326.
3. Черных, В. П. Общий практикум по органической химии / В. П. Черных, И. С. Гриценко, З. И. Коваленко. – Х.: Изд–во НФАУ; Золотые страницы, 2002, с. 323-328.
4. Сборник тестов по органической химии / Под редакцией чл.-корр. НАН Украины, проф. Черных В. П. – Харьков: Изд-во НФаУ: Золотые страницы, 2005, с. 209-225.
ЗАДАЧИ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
1. Уретаны - производные угольной кислоты. Согласно систематической номенклатуре они называются:
A. Эстер карбаминовой кислоты;
B. Полный амид угольной кислоты;
C. N-ацильные производные мочевины;
D. Неполный амид угольной кислоты;
E. Циклический уреиды малоновой кислоты.
2. В зависимости от внешних условий и целей извлечения мочевины может быть проведено различными способами. Для извлечения в промышленности используют реагенты:
A. NH3 и СО;
B. NH3 и Н2СО3;
C. NH3 и НСООН;
D. NH3 и СО2;
E. НNО3 и СО2.
3. Фосген является хлорангидрид угольной кислоты. Его получают по реакции взаимодействия:
A. СО2 и Cl2 (hv);
B. СО и НCl;
C. СО и Cl2 (hv);
D. СО2 и НCl;
E. НСООН и Cl2 (hv).
4. Для идентификации мочевины использовали биуретовую реакцию. Она протекает в условиях:
A. Образование биурета при нагревании мочевины до 150-160 ОС;
B. Образование комплекса биурета с ионами меди (II);
C. Реакция тримеризации изоциановой кислоты;
D. Образование комплекса между циануровой кислотой и Cu (II);
E. Образование барбитуровой кислоты.
5. Надо провести реакции качественного определения мочевины и белков - веществ содержащих группу -СО-NH-. Какой реагент используется для этого?
A. FeCl3;
B. AgNO3;
C. J2 + NaOH;
D. Cu(OH)2;
E. Br2, H2O/
Эталоны ответов:
1. A, 2.D, 3.C, 4.B, 5D.






