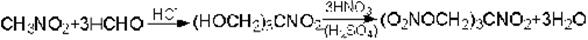Процессы присоединения и конденсации по карбонильной группе занимают очень важное место в промышленности органического синтеза. Из-за доступности альдегидов и кетонов и их высокой реакционной способности изних можно синтезировать растворители и другие ценные продукты. Взаимодействие альдегидов и кетонов с различными веществами может остановиться на стадии присоединенияих по карбонильной группе
а может дальше конденсироваться со второй молекулой реагента с отщеплением воды
может также завершиться внутримолекулярной дегидратацией
Эти процессы можно отнести к двум основным типам.
1. Реакции альдегидов и кетонов с основаниями в широком смысле – к ним относятся соединения с неподеленными электронными парами на гетероатоме (азотистые основания, спирты) и p-электронными системами (олефины, ароматические соединения).
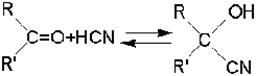
2. Реакции альдегидов и кетонов со слабыми кислотами (HCN) и псевдокислотами (карбонильные и нитросоединения и другие вещества с активированным атомом водорода), то есть реакции альдольной конденсации в широком смысле.
Конденсации по карбонильной группе с ароматическими соединениями
Реакции альдегидов и кетонов с ароматическими соединениями принадлежат к реакциям электрофильного замещения. Катализаторами являются протонные кислоты (серная, сульфокислота, хлористый водород, катионообменные смолы). Они переводят карбонильные соединения в положительно заряженный ион карбония, атакующий ароматическое ядро через промежуточное образование p- и s-комплексов:
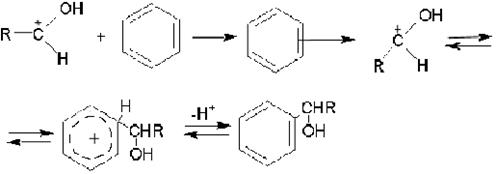
Образовавшийся спирт в кислой среде реагирует дальше и дает диарилалкан:
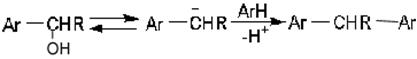
Реакционная способность карбонильных и ароматических соединений меняется в данных процессах в обычном порядке. Галогенбензолы еще способны к этим превращениям, но ароматические вещества с более электроотрицательными группами в реакцию не вступают.
Побочными продуктами конденсации карбонильных соединений с ароматическими всегда оказываются ди- и полизамещенные в ядре вещества
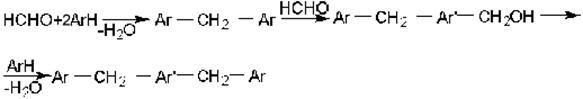
и так далее
Для уменьшения образования этих веществ нужно применять избыток ароматического соединения.
Получение диаминофенилметанов
Конденсация формальдегида с анилином приводит к последовательному образованию продуктов:
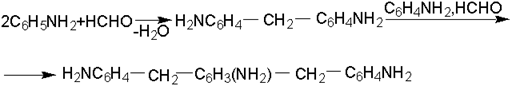
Состав смеси зависит от мольного соотношения формальдегида к анилину.
Реакцию проводят, нагревая формалин с анилином.
Получение ДДТ
Дихлордифенилтрихлорметилметан получают конденсацией хлорбензола с хлоралем в присутствии концентрированной серной кислоты или олеума:
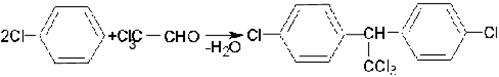
Долгое время ДДТ был основным инсектицидом, широко применяемым в быту и сельском хозяйстве для борьбы с вредными насекомыми. В настоящее время его не используют из-за высокой токсичности и слабой разлагаемости в почве, а также способности накапливаться в организмах животных. Во многих странах его применение запрещено.
Реакция хлорметилирования
Введение хлорметильной группы в ароматическое ядро достигается при действии формалина (или параформа) и соляной кислоты на ароматический углеводород:
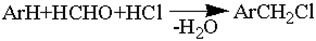
Хлорметилированием бензола в присутствии солянокислого раствора хлористого цинка в промышленности получают хлористый бензил
C6H6 + HCHO + HCl → C6H5-CH2Cl + H2O
Синтез ацеталей
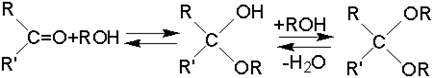
Полуацетали и ацетали RCH(OH)OR' и RCH(OR')2 получаются при взаимодействии спиртов с альдегидами, катализируемом HCl, H2SO4 иликислыми солями этих кислот по обратимой реакции:
RCHO + 2R'OH ↔ RCH(OR')2 + H2O
Значительно более стабильны циклические ацетали 1,2-гликолей – так называемые 1,3-диоксоланы:
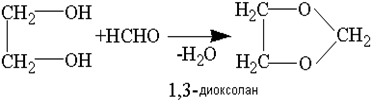
Их производят в промышленном масштабе, так как они являются хорошими растворителями эфиров целлюлозы.
Циклическими ацеталями 1,3-гликолей являются 1,3-диоксаны:
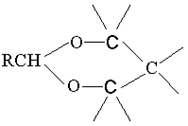
Реакция Принса
Это реакция конденсации альдегидов с олефинами в отсутствии катализаторов кислотного типа. В зависимости от условий проведения реакции получаются в основном производные 1,3-диоксана или 1,3-гликоли, а также побочные продукты – ненасыщенные одноатомные спирты, насыщенные спирты и более сложные соединения:
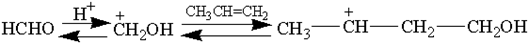
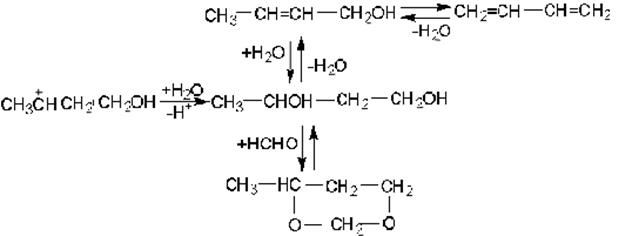
При повышении температуры может происходить дегидратация гликоля и ненасыщенного спирта с получением диена. Возможна гидратация исходных олефинов:
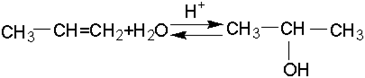
1,3-Диоксаны являются главными продуктами конденсации при умеренных температурах (до 90-100°С) и избытке формальдегида. Образованию 1,3-гликоля способствуют недостаток формальдегида и повышение температуры.
Конденсация альдегидов и кетонов с азотистыми основаниями
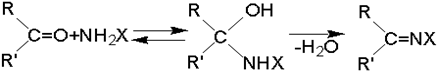
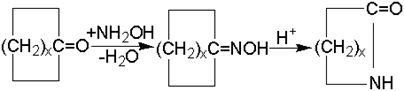
Взаимодействие альдегидов и кетонов с азотистыми основаниями (аммиак, амины, гидроксиламин) протекает, по крайней мере, через две стадии. Первая стадия - присоединение по карбонильной группе с образованием алкилольного производного (I), вторая - дегидратация в азометиновое производное (II):
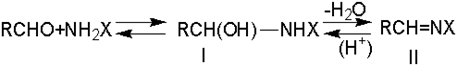
С наиболее реакционноспособным формальдегидом первая стадия не требует катализаторов, но вторая ускоряется кислотами, которые катализируют и первую стадию.
Важнейшим промышленным применением реакций конденсации кетонов с азотистыми основаниями является производство оксимов (из циклоалканонов и гидроксиламина), которые перегруппировываются по Бекману в лактамы:
Лактамы являются внутренними амидами аминокислот, их называют по соответствующей карбоновой кислоте. При полимеризации лактамов, идущей с раскрытием цикла, получают наиболее распространенные виды полиамидов:
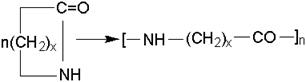
Их называют по числу углеродных атомов в лактаме (найлон-5, найлон-6 и т.д.) или по карбоновой кислоте (капрон, поликапроамид).
Реакции типа альдольной конденсации
Под альдольной конденсацией в широком смысле понимают конденсацию альдегидов и кетонов друг с другом
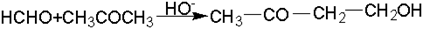
или с веществами, содержащими связанный с углеродным атомом подвижный атом водорода (с псевдокислотами), например, с нитросоединениями:
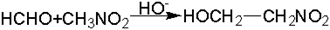
Одна молекула карбонильного соединения реагирует при этом по карбонильной группе, а вторая - по активированной электроотрицательным заместителем a-метиленовой группе.
Роль основания как катализатора состоит в том, что оно переводит метиленовую компоненту в очень реакционноспособный анион:
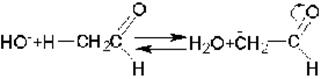
По этой причине реакция всегда протекает по a-атому углерода, смежному с электроотрицательной группировкой. Образовавшийся анион является сильным нуклеофилом и непосредственно взаимодействует с карбонильным углеродным атомом карбонильной компоненты. После этого промежуточный анион с отрицательным зарядом на атоме кислорода превращается альдоль:
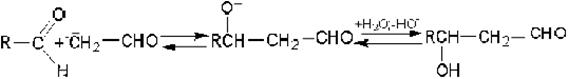
В системе альдегид – кетон роль карбонильной компоненты обычно выполняет альдегид:
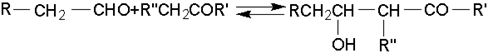
Некоторые нитроспирты получают конденсацией формальдегида с алифатическими нитросоединениями. Так из нитрометана в присутствии щелочи при комнатной температуре получают триметилолнитрометан, который при дальнейшем нитровании дает мощное взрывчатое вещество, превосходящее нитроглицерин: