Главное отличие идеального газа от реального заключается в том, что в модели первого вещества практически не учитывается объем молекул, а также энергия их взаимодействия. В реальном газе соответствующие показатели учитываются. Вместе с тем при невысоком давлении и большой температуре реальный газ по своим свойствам близок к идеальному.
Сравнительная таблица
| Идеальный газ | Реальный газ |
| Что общего между ними? | |
| При определенных условиях реальный газ может быть приближен по свойствам к идеальному | |
| В чем разница между ними? | |
| Модель описания вещества не учитывает объем его молекул, а также энергию их взаимодействия друг с другом | Модель описания вещества учитывает объем его молекул и силу их взаимодействия |
Количество вещества
Так как размеры молекул очень малы, то чтобы избежать использования таких чисел в расчетах были введены такие величины, как:
Ar – относительная атомная масса вещества. (указана в таблице Менделеева)
Например здесь ArN=14.
Mr – относительная молекулярная масса. (она находится как сумма относительных атомных масс всех элементов входящих в молекулу)
Например:
молекула N2=>MrN2=2*14=28
Один моль – это количество вещества, в котором содержится столько же молекул и атомов, сколько атомов содержится в 0,012 кг углерода.
Число молекул, содержащихся в одном моле любого вещества - одинаково и называется числом Авогадро (NA).
NA=6,02*1023моль-1.
v=N/NA=m/M - количество вещества или количество молей вещества
N – число молекул вещества
m – масса вещества
М – молярная масса вещества (масса 1 моля вещества)
M=m0NA
т0 – масса молекулы
M=Mr*10-3кг/моль
Например: М (Н2О)=18.10-3кг/моль
Число молекул газа N можно выразить:
 N=mNA/M.
N=mNA/M.
Массу одной молекулы m0можно определить по формуле:
m0=m/N=M/NA.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0 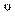 С (273 К) и давлении 101,3 кПа ) 10×занимает объем, равный 22,4 л. В этом объеме содержится 6,0223 молекул газа (число Авогадро).
С (273 К) и давлении 101,3 кПа ) 10×занимает объем, равный 22,4 л. В этом объеме содержится 6,0223 молекул газа (число Авогадро).
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
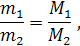
где m1 и m2 – массы,
 М1 и М2 – молекулярные массы первого и второго газов.
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
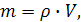
где ρ – плотность г аза,
V – объем газа,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях  ) на основании отношения молярной массы М к объему моля:
) на основании отношения молярной массы М к объему моля:
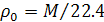 .
.
Из этого уравнения можно определить молярную массу газа:
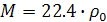 .
.






