Для равновесия между жидкостью и паром уравнение Клапейрона-Клаузиуса может быть получено следующим образом.
Согласно второму закону термодинамики если система находится в равновесии, то при данных условиях (Р, Т) работа не совершается
Ap = 0; Gж - Gп = 0; Gж = Gп (2)
то есть свободные энергии Гиббса чистой жидкости и её пара равны (это условия равновесия).
Изменим одно из условий, определяющих равновесие, например, температуру (то есть нагреем систему на Т), в результате этого установится новое давление, новое равновесие жидкость-пар:
G'ж = G'п (3)
или Gж = Gп (4)
Если изменение внешнего параметра произойдет на бесконечно малую величину - dT, то и изобарно-изотермические потенциалы изменятся на бесконечно малую величину:
dGж = dGп (5)
Изобарно-изотермический потенциал представляет собой свободную энергию системы и является функцией давления и температуры:
dG = VdP – SdT (6)
поэтому с его помощью можно установить количественную зависимость между давлением насыщенного пара и температурой.
После подстановки (6) в (5) имеем в состоянии равновесия
VжdP - SжdT = VпdP - SпdT (7)
откуда 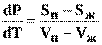 (8)
(8)
где (Sп - Sж) и (Vп- Vж) - изменение соответственно энтропии и объема системы при переходе вещества из жидкого в парообразное состояние. Согласно второму закону термодинамики изменение энтропии системы при испарении равно приведенной теплоте испарения
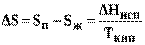 (9)
(9)
Подставив выражение (9) в (8) получим
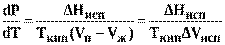 (10)
(10)
где ∆ Hисп и ∆ Vисп - соответственно изменение энтальпии и объема при испарении, а Tкип - температура кипения.
Уравнение (10) называется уравнением Клапейрона-Клаузиуса. Согласно (10) наклон линий на фазовой диаграмме воды (рис. 1) определяется знаком производной dP/dT или обратной ей величины dT/dP - характеризующей изменение температуры с увеличением давления.
Из фазовых переходов рассмотрим испарение и плавление. Теплота испарения - перехода жидкой фазы в газообразную положительна. Молярной теплотой испаренияназывается количество тепла, затраченное на испарение одного моля жидкого вещества. Объем газа при испарении всегда больше соответствующего объема жидкости, то есть в уравнении (10) Vп> Vж. Поэтому dP/dT, а значит, и dT/dP также всегда положительны (dT/dP > 0). Следовательно, температура испарения всегда повышается с ростом давления (кривая ОК на рис. 1 или см. табл. 1 Приложения). С увеличением температуры давление насыщенного пара над жидкостью возрастает, принимая максимальное значение при критической температуре. Последняя является предельной температурой (например, для воды она равна 374,12оС) при которой возможно равновесие между жидкой и паровой фазой вещества. При более высоких температурах вещество может находиться только в газообразном состоянии, и понятие насыщенного пара теряет свой смысл.
Теплота плавления - перехода твердой фазы в жидкую также всегда положительна.
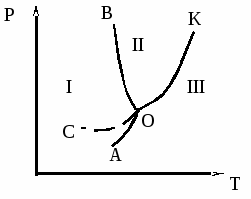 Рис. 1. Диаграмма состояния воды при невысоких давлениях
Рис. 1. Диаграмма состояния воды при невысоких давлениях
Области: 1 - твердая фаза (лед); II- жидкость; III - пар.
Кривые: АО - возгонки; ОК - испарения; ОВ - плавления.
О - тройная точка, отвечающая равновесию трех фаз.
Объем жидкой фазы в общем случае может быть больше или меньше объёма того же количества твердой фазы. Отсюда в соответствии с уравнением (10) вытекает, что величина dP / dT или обратная её величина dT / dP, может быть положительной или отрицательной. Это значит, что температура плавления может повышаться или снижаться с увеличением давления. Величина dT / dP положительна для большинства веществ. Она имеет отрицательное значение лишь для воды, висмута и немногих других веществ, для которых плотность жидкости при температуре плавления больше плотности твердой фазы (Vж - Vт) < 0. В связи с этим при увеличении давления температура плавления льда понижается (кривая ОВ).
Необходимо отметить, что рассмотренные закономерности справедливы для невысоких давлений.
Уравнение Клапейрона-Клаузиуса (10) можно преобразовать приняв следующие приближения:
1) Поскольку ∆ Vисп =(Vп - Vж) >> 0 (например, для воды мольный объём в парообразном состоянии при н.у. Vп ≈ 22400 см2, а в жидком состоянии Vж ≈ 18 см3), то без большой погрешности можно пренебречь величиной Vж и принять, что∆ Vисп ≈ Vп.
2) При не слишком высоких давлениях и температурах (вдали от критических) можно применять уравнение состояния для идеальных газов и к реальным системам. Погрешность, получаемая при этом, оказывается незначительной.
Тогда
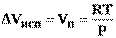 (11)
(11)
Подставив (11) в (10) получим:
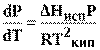 (12)
(12)
которое после преобразования
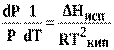 (13)
(13)
принимает вид
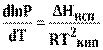 (14)
(14)
Теплота испарения зависит от температуры: с повышением температуры теплота испарения понижается. При критической температуре теплота испарения равна нулю. Однако при температурах, далеких от критической, изменения∆ Нисп с температурой не очень велики. В не слишком большом интервале температур∆ Нисп можно считать постоянной.
Интегрирование уравнения Клапейрона-Клаузиуса (14) в пределах температур Т 1 и Т 2, которым отвечают давления Р 1 и Р 2 при постоянном значении ∆ Нисп, дает
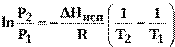 (15)
(15)
или при переходе к десятичным логарифмам
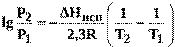 (16)
(16)
(R - универсальная газовая постоянная равная 8,314 Дж/моль · К).
Уравнения (15), (16) позволяют рассчитать теплоту испарения. Для этого по экспериментальным данным строят зависимость lnP = f (1/ T) или lgP = f (1/ T) и на полученной прямой выбирают две точки (рис. 2). Подставляют соответствующие этим точкам значения логарифма давления и обратной температуры в уравнение (17):
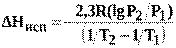 (17)
(17)
Значение∆ Нисп по уравнению (17) зависит от взятого интервала температур и тем ближе к истинному, чем этот интервал меньше. Однако для такого вычисления требуется весьма точное измерение температуры кипения и давления пара.
Для вычисления∆ Нисп в относительно широком интервале температур (50...100оС) следует выбирать точки, наиболее точно укладывающиеся на прямую lgP = f (1/ T).
Температура кипения жидкости, давление пара при данной температуре и теплота испарения являются специфическими константами вещества, значения которых необходимы для многих теоретических и практических расчетов. На основе этих данных можно определять чистоту химических веществ, провести расчет разделения смесей путем перегонки, рассчитать энергетические затраты на испарение жидкости, необходимые для проведения реакции в газовой фазе.






