ѕри решении задач следует иметь в виду:
а) ћол€рна€ масса эквивалента гидроксида равна сумме мол€рных масс эквивалентов металла и гидроксильной группы;
б) ћол€рна€ масса эквивалента соли равна сумме мол€рных масс эквивалентов металла и кислотного остатка. “аким образом, мол€рна€ масса эквивалента химического соединени€ равна сумме мол€рных масс эквивалентов составл€ющих его частей.
«адача1. –асчет количества вещества по числу структурных единиц.
акое количество вещества гидроксида меди (II) содержит 1,505Ј1023атомов водорода?
–ешение: оличество вещества гидроксид-ионов в гидроксиде меди (II), выраженное в моль, составл€ет:
 (ќЌ-) =
(ќЌ-) = 
¬ соответствие с формулой гидроксида меди (II) Ц —u(OH)2, в одной молекуле этого соединени€ содержитс€ два гидроксид-иона. Ёто означает, что
 (Cu(OH)2) =
(Cu(OH)2) = 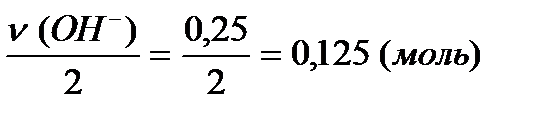 .
.
ќтвет: 0,125 моль.
* ¬ этом и последующих примерах обозначение единицы измерени€ пишетс€ после числового значени€ величины в конце расчЄта и во всех промежуточных вычислени€х (в соответствии с прин€тым стандартом). ¬ учебной литературе по химии встречаетс€ и така€ запись, где единица измерени€ вставл€етс€ в формулу.
«адача 2. –асчет мол€рной массы эквивалента элемента по составу химического соединени€ на основе закона эквивалентов.
ќксид металла содержит 28,57% кислорода. ќпределите мол€рную массу эквивалента металла.
–ешение: ¬ соответствии с законом эквивалентов массы св€занных между собой в химическом соединении металла m(Me) и кислорода m(O) пропорциональны мол€рным массам их эквивалентов
 =
= 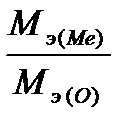 (1)
(1)
ѕолага€ массу оксида равной 100 г, имеем m(O)=28,57 г и m(Me)=71,43г. ѕоскольку мол€рна€ масса эквивалента кислорода ћэ(ќ)=8г/моль, из выражени€ 1 находим мол€рную массу эквивалента металла:
ћэ(ће)= 
ќтвет: 20 г/моль.
«адача 3. –асчет мол€рной массы эквивалента вещества по массе и объему участвующих в реакции веществ на основе закона эквивалентов.
2,14 г металла вытесн€ют из кислоты 2 л водорода (н.у.). ¬ычислите мол€рную массу эквивалента металла.
–ешение: —огласно закону эквивалентов количество вещества эквивалентов металла равно количеству вещества эквивалентов водорода
 (2)
(2)
 э.(Me)=
э.(Me)=  ;
;  э.(H2) =
э.(H2) =  , где (3)
, где (3)
 (H2) Ц эквивалентный объем водорода, равный
(H2) Ц эквивалентный объем водорода, равный
 ;
;
VmЦ мол€рный объем газа при н.у., равный 22,4 л/моль.
“огда в соответствии с выражени€ми (2) и (3)

 , откуда
, откуда
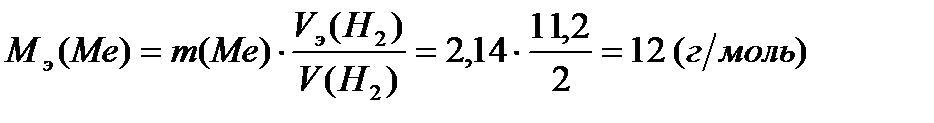 .
.
ќтвет: 12 г/моль.
«адача 4. –асчет мол€рной массы эквивалента элемента по соотношению масс реагента и продукта реакции на основе закона эквивалентов.
»з 3,85 г нитрата металла получено 1,6 г его гидроксида. ¬ычислите мол€рную массу эквивалента металла.
–ешение: ¬ соответствии с законом эквивалентов соотношение масс нитрата и гидроксида металла равно
 =
= 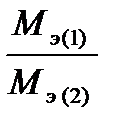 (4)
(4)
ћол€рные массы эквивалентов нитрата и гидроксида металла равны
Mэ1 = Mэ(Me) + Mэ(NO3-) = Mэ(Me) + 62
Mэ2 = Mэ(Me) + Mэ(OH-)= Mэ(Me)+17
ѕодставл€€ эти выражени€ в уравнение (4) имеем
 =
=  или
или  =
=  .
.
–еша€ последнее уравнение относительно Mэ(Me), имеем
Mэ(Me)=15г/моль.
ќтвет: 15 г/моль.
|
|
|
«адача 5. ќпределение молекул€рной массы газообразного вещества на основе его плотности.
ћасса 1 л газа при н.у. равна 1,175 г. ¬ычислите молекул€рную массу газа и массу одной молекулы газа.
–ешение: ѕоскольку один моль газа при нормальных услови€х занимает объем 22,4 л, его мол€рна€ масса равна
ћ(газа) = 1,175 Ј 22,4 = 26,32 (г/моль).
ѕоскольку в 1 моль любого вещества содержитс€ 6,02 Ј 1023 молекул, масса одной молекулы определ€етс€ по формуле
m= 
ќтвет: 4,372 Ј 10-23г.
«адача 6. ќпределение фактора эквивалентности и мол€рной массы эквивалента вещества в окислительно-восстановительной реакции.
ѕри взаимодействии алюмини€ и серы образуетс€ сульфид алюмини€. ¬ычислите факторы эквивалентности и мол€рные массы эквивалентов алюмини€ и серы.
–ешение: ‘актор эквивалентности Ц это число, обозначающее, кака€ дол€ реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
–еакци€ взаимодействи€ алюмини€ и серы протекает согласно уравнению:
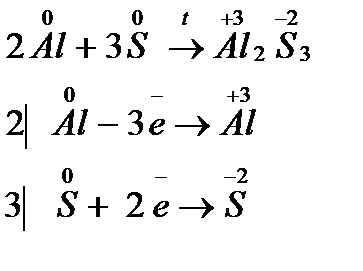
аждый атом алюмини€ отдает три электрона, а каждый атом серы принимает два электрона. ѕоэтому
fэкв(Al) = 1/3, fэкв(S) = 1/2.
ћол€рна€ масса эквивалента вещества Ц это масса вещества, эквивалентна€ 1 моль ионов водорода в кислотно-основной реакции или 1 моль электронов в окислительно-восстановительной реакции. ћол€рна€ масса эквивалента равна произведению фактора эквивалентности на мол€рную массу вещества:
ћэкв(Al) = fэкв(Al) Ј M(Al);
Ar(Al) = 27; M(Al) = 27 г/моль; ћэкв (Al) = 1/3Ј27 = 9 г/моль;
ћэкв(S) = fэкв(S) Ј M(S);
Ar(S) = 32; M(S) = 32 г/моль; ћэкв(S) = 1/2Ј32 = 16 г/моль.
ќтвет: 1/3 и 9 г/моль; ½ и 16 г/моль.
ѕриведенные ниже примеры иллюстрируют основные методы определени€ мол€рных масс эквивалента простых веществ: метод пр€мого определени€ (пример 7), аналитический метод (пример 8); электрохимический метод (пример9). ƒл€ краткости слова Ђмол€рна€ масса эквивалентаї заменены словом Ђэквивалентї
«адача 7. ѕри сжигании 2,28 г металла было получено 3,78 г его оксида. ќпределить эквивалентную массу металла.
–ешение: Ќаходим массу кислорода, пошедшего на окисление металла: 3,78 Ц 2,28 = 1,5 г. ћол€рна€ масса эквивалента кислорода ћЁ(ќ2)=8 г/моль. »спользуемзакон эквивалентов

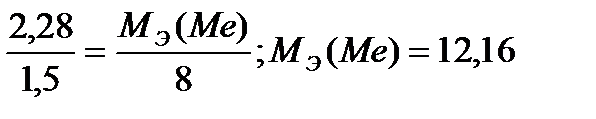 г/моль
г/моль
ќтвет: 12,16 г/моль.
«адача8. ¬ычислить мол€рную массу эквивалента металла, если установлено химическим анализом, что сульфид металла содержит 67,15 % металла (по массе), а эквивалент серы равен 16.
–ешение: 67,15 массовой части металла соедин€ютс€ 32,85 части массы серы (100-67,15), а мол€рна€ масса эквивалента металла соедин€ютс€ с мол€рной массой эквивалента серы (закон эквивалентов)

ќтвет: 32,71 г/моль
«адача 9. ќпределить эквивалент никел€, если дл€ выделени€ на катоде 4 г металла было пропущено через раствор его соли 13150 кулонов ( л) электричества.
–ешение: ¬ соответствии с уравнением, объедин€ющим первый и второй закон ‘араде€,  гдеm-масса продукта электролиза,Ё - эквивалент металла, (мол€рна€ масса эквивалента) F Цчисло ‘араде€ (96500 л) Q Цколичество прошедшего через раствор электричества.
гдеm-масса продукта электролиза,Ё - эквивалент металла, (мол€рна€ масса эквивалента) F Цчисло ‘араде€ (96500 л) Q Цколичество прошедшего через раствор электричества.
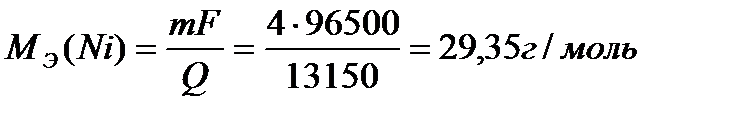
ќтвет: 29,35 г/моль.
–асчеты по химическим формулам. ћассова€ дол€.
“ермин Ђдол€ї означает часть от какой-то величины. ƒл€ химического элемента, наход€щегос€ в смеси с другими веществами, может быть найдена массова€ дол€, мол€рна€ дол€, объЄмна€ дол€. ƒл€ вычислени€ доли одного из веществ нужно его массу (число молей, объЄм) разделить на сумму масс (молей, объЄмов) всех составных частей.
|
|
|

јналогично можно вычислить массовую долю одного из элементов в сложном веществе. ƒл€ этого массу элемента дел€т на массу всего вещества:

массова€ дол€ элемента определ€етс€ по формуле:

где ω(э) Цмассова€ дол€ элемента; n Цчисло атомов элемента в соединении; Ar(э) Цатомный вес элемента,а.е.м; ћ(в-ва) Цмол€рна€ масса вещества, г/моль.
«адача 10. ¬ычислите массовую долю углерода в карбиде кальци€. –ешение:
ћ(—а—2) = 40+12∙2 = 64 г/моль  ќтвет: 37,5%
ќтвет: 37,5%
√азовые законы
ѕод парциальным давлением газа –п понимают давление этого газа в предположении, что при температуре смеси в объЄме, занимаемом смесью, находитс€ только рассматриваемый газ. ¬ соответствии с законом ƒальтона, давление смеси идеальных газов равно сумме парциальных давлений этих газов: –= 
ƒл€ описани€ состо€ни€ идеального газа пользуютс€ уравнением ћенделеева- лапейрона:
–V=  , где: P Ц давление газа, ѕа; V Ц объЄм газа, м3; T Ц температура газа, ; m Ц масса газа, кг; M Ц мольна€ масса газа, кг/моль; R=8,31 ƒж/(моль* ) Ц универсальна€ газова€ посто€нна€.
, где: P Ц давление газа, ѕа; V Ц объЄм газа, м3; T Ц температура газа, ; m Ц масса газа, кг; M Ц мольна€ масса газа, кг/моль; R=8,31 ƒж/(моль* ) Ц универсальна€ газова€ посто€нна€.
”равнением, объедин€ющим газовые законы Ѕойл€-ћариотта и √ей-Ћюссака, €вл€етс€:
 , где: индекс Ђ0ї означает начальное состо€ние системы, например, при нормальных услови€х; индекс Ђ1ї означает некоторое конечное состо€ние системы. Ќормальными услови€ми (н.у.) считают –0 =101,3кѕа (нормальное атмосферное давление) и “0=298 (25∞—). ќднако во многих случа€х приходитс€ использовать в качестве нормальной температуры не 298 , а 273 (0∞—). Ёто обусловлено тем, что многие справочные данные, необходимые дл€ расчЄтов, получены не при 298 , а именно при 273 .
, где: индекс Ђ0ї означает начальное состо€ние системы, например, при нормальных услови€х; индекс Ђ1ї означает некоторое конечное состо€ние системы. Ќормальными услови€ми (н.у.) считают –0 =101,3кѕа (нормальное атмосферное давление) и “0=298 (25∞—). ќднако во многих случа€х приходитс€ использовать в качестве нормальной температуры не 298 , а 273 (0∞—). Ёто обусловлено тем, что многие справочные данные, необходимые дл€ расчЄтов, получены не при 298 , а именно при 273 .
ѕлотность любого газа можно определить как:
 , кг/м3. √де: ћг Ц мольна€ масса газа; Vст=22,4 л/моль Ц объЄм, занимаемый 1 молем любого газа при н.у. (стандартный объЄм).
, кг/м3. √де: ћг Ц мольна€ масса газа; Vст=22,4 л/моль Ц объЄм, занимаемый 1 молем любого газа при н.у. (стандартный объЄм).
ѕлотность смеси газов определ€етс€ следующим образом:
 , кг/м3. √де: ri Ц плотность итого газового компонента смеси,кг/м3; gi Ц объЄмное содержание итого газового компонента смеси, %; n Ц количество газовых компонентов смеси.
, кг/м3. √де: ri Ц плотность итого газового компонента смеси,кг/м3; gi Ц объЄмное содержание итого газового компонента смеси, %; n Ц количество газовых компонентов смеси.
Ќапример, плотность атмосферного воздуха при н.у. составл€ет 1,29 кг/м3.
ѕлотность функционально зависит от температуры “ и давлени€ –:
¬ыведем функциональную зависимость плотности от температуры и давлени€. ƒл€ этого запишем объединЄнное уравнение в форме:


 .
.

јналогично плотности смеси газов рассчитываетс€ мольна€ масса смеси газов:
 , г/моль. √де: ћi Ц мольна€ масса итого газового компонента смеси, г/моль; gi Ц объЄмное содержание итого газового компонента смеси, %; n Ц количество газовых компонентов смеси.
, г/моль. √де: ћi Ц мольна€ масса итого газового компонента смеси, г/моль; gi Ц объЄмное содержание итого газового компонента смеси, %; n Ц количество газовых компонентов смеси.
Ќапример, мольна€ масса атмосферного воздуха при н.у. составл€ет около 29 г/моль.
ќсновные газовые процессы
ѕроцессы, в которых участвует система, могут протекать при различных услови€х. ¬ св€зи с этим различают следующие основные варианты реализации указанных процессов.
1. »зохорный процесс. ќбъЄм системы остаЄтс€ посто€нным (ΔV=0). 2. »зобарный процесс. ƒавление –=соnst.
3. »зотермический процесс. “=const.
4. јдиабатический процесс. ΔQ=0. ѕри адиабатическом процессе работа совершаетс€ системой за счЄт убыли еЄ внутренней энергии.
—ледует отметить, что наиболее общим случаем всех газовых процессов €вл€етс€ политропный процесс (соотношение параметров выражено через величину n - показатель политропы).






