√осударственное бюджетное профессиональное
ќбразовательное учреждение
”–√јЌ— »… Ѕј«ќ¬џ… ћ≈ƒ»÷»Ќ— »… ќЋЋ≈ƒ∆
—борник лекций по химии
(часть I ЂЌеорганическа€ хими€ї)
31.02.03 ЂЋабораторна€ диагностикаї
—борник лекций по химии (часть I ЂЌеорганическа€ хими€ї), дл€ специальности 31.02.03 ЂЋабораторна€ диагностикаї/авт.-сост. ≈.Ќ. ћозжухинаЦ преподаватель химии √Ѕќ” —ѕќ Ђ урганского базового медицинского колледжаї высшей квалификационной категории √Ѕќ” —ѕќ Ѕћ .- урган, 2012.-92с.;
јвтор-составитель: ≈.Ќ. ћозжухина- преподаватель химии √Ѕѕќ” Ђ урганский базовый медицинский колледжї высшей квалификационной категории.
–ецензенты: Ќ.≈.√оршкова- кандидат биологических наук, заместитель директора по »ћ– √Ѕѕќ” Ђ урганский базовый медицинский колледжї
ƒанное учебное пособие по предмету Ђ’ими€ї (часть I ЂЌеорганическа€ хими€ї) разработана на основе ‘едерального государственного образовательного стандарта среднего профессионального образовани€ (‘√ќ— —ѕќ) по специальности 31.02.03 ЂЋабораторна€ диагностикаї.
”чебное пособие может быть использовано дл€ самосто€тельной внеаудиторной подготовке студентов к зан€ти€м, на практических зан€ти€х и при подготовке к зачетам и экзаменам.
”чебное пособие предназначено дл€ студентов медицинских училищ и колледжей.
—одержание
| 1. ¬ведениеЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕ.. | |
| 2. Ћекци€ є 1. —троение атома и периодический закон ƒ.». ћенделеева... | |
| 3. Ћекци€ є 2. ’имическа€ св€зь и строение молекулЕЕЕЕЕЕЕЕ... | |
| 4. Ћекци€ є 3. Ёлементы химической термодинамикиЕЕЕЕЕЕЕЕ. | |
| 5. Ћекци€ є 4. –астворы и их коллигативные свойстваЕЕЕЕЕЕЕЕ. | |
| 6. Ћекци€ є 5. —пособы выражени€ количественного состава растворовЕ | |
| 7. Ћекци€ є 6. “еори€ электролитической диссоциации. 8. ѕротеолитическа€ теори€ кислот и оснований. 9. √идролиз солейЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕ | |
| 10. Ћекци€ є 7. ќкислительно-восстановительные процессыЕЕЕЕЕЕ | |
| 11. ЋитератураЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕЕ |
ѕо€снительна€ записка
урс неорганической химии в учреждени€х профессионального образовани€ по медицинским специальност€м должен способствовать созданию у студентов прочной базы дл€ овладени€ в последующем специальными дисциплинами: биохимией, биологией, генетикой, микробиологией и другими, а также способствовать развитию мышлени€ и понимани€ закономерностей химических процессов в живых организмах на молекул€рном уровне.
¬ лекционном материале изложены вопросы, освещающие медико-биолоическое значение, использование в медицине изучаемых соединений в соответствии с их структурой и химическими свойствами, то есть прослеживаетс€ св€зь структуры и функции различных химических соединений.
¬ данном пособии включен лекционный материал по неорганической химии, разработанный на основе ‘едерального государственного образовательного стандарта среднего профессионального образовани€. (‘√ќ— Ц 4).
|
|
|
“еоретический материал объединен в 5 разделов:6
1. Ђ—троение веществї - 2 лекции;
2. Ёлементы химической термодинамики Ц 1 лекци€;
3. Ђ–астворы. ƒисперсные системыї Ц 2 лекции;
4. Ђ–астворы электролитов и ионные равновеси€ї - 1 лекци€;
5. Ђќкислительно-восстановительный процессї - 1 лекци€.
¬ соответствии с программой по курсу ЂЌеорганическа€ хими€ї студент должен знать:
–аздел.
вантово-механическую модель атома. ѕериодический закон и периодическую систему ƒ.». ћенделеева в свете учени€ о строении атома. ѕериодические свойства элементов (энерги€ ионизации, сродство к электрону, электроотрицательность, радиус атомов. ѕрироду, классификацию, элементарные характеристики химической св€зи. √ибридизацию и пространственную конфигурацию молекул.
–аздел.
Ёлементы химической термодинамики. ќсновные пон€ти€ термодинамики: внутренн€€ энерги€, теплота, работа, энтальпи€. »зменение энтальпии при химической реакции. —амопроизвольные процессы. Ёнергию √иббса.
–аздел.
–астворы. оллигативные свойства разбавленных растворов. ¬ода как растворитель. –астворение как физико-химический процесс. ƒисперсные системы. Ћиофобные и лиофильные коллоидные растворы. —пособы выражени€ количественного состава растворов.
–аздел.
“еорию электролитической диссоциации. ќсобенности растворов сильных электролитов. ѕротеолитическую теорию кислот и оснований. √идролиз различных типов солей. —тепень гидролиза.
–аздел.
ќкислительно-восстановительные процессы. ќсновные пон€ти€ и факторы. —оставление уравнений ќ¬– и расстановку коэффициентов методом электронного баланса и ионно-электронным методом.
ƒл€ лучшего понимани€ материала в лекци€х имеютс€ рисунки, схемы.
ƒл€ закреплени€ материала к каждой лекции предлагаютс€ контрольные вопросы, управлени€ и задачи.
ƒанное пособие позвол€ет экономить врем€, облегчает работу студентам по подготовке к практическим зан€ти€м, а так же дает возможность дл€ более глубокой проработки учебного материала.
Ћекци€ є 1
“ема: Ђ—троение атома и периодический закон ƒ.». ћенделееваї
ѕлан
1. —троение атома и изотопы.
2. вантовые числа. ѕринцип ѕаули.
3. ѕериодическа€ система химических элементов в свете теории строени€ атома.
4. «ависимость свойств элементов от строени€ их атомов.
ѕериодический закон ƒ.». ћенделеева вскрыл взаимную св€зь химических элементов. »зучение периодического закона поставило р€д вопросов:
1. ¬ чем причина сходства и различи€ элементов?
2. „ем объ€сн€етс€ периодическое изменение свойств элементов?
3. ѕочему соседние элементы одного периода значительно отличаютс€ по свойствам, хот€ их атомные массы отличаютс€ на небольшую величину, и наоборот, в подгруппах разница в атомных массах соседних элементов больша€, а свойства сходные?
4. ѕочему расположение элементов в пор€дке возрастани€ атомных масс нарушаетс€ элементами аргон и калий; кобальт и никель; теллур и йод?
Ѕольшинство ученых признавали реальное существование атомов, но придерживались метафизических взгл€дов (атом сама€ мельчайша€ неделима€ частица вещества).
¬ конце XIX было установлено сложное строение атома и возможность превращени€ при определенных услови€х одних атомов в другие. ѕервыми обнаруженными в атоме частицами были электроны.
|
|
|
Ѕыло известно, что при сильном накаливании и при освещении ”‘Ћ с поверхности металлов отрицательное электронных и металлы зар€жаютс€ положительно. ¬ вы€снении природы этого электричества большое значение имели работы русского ученого ј.√. —толетова и английского ученого ”. рукса. ¬ 1879 г. рукс исследовал €влени€ электронных лучей в магнитном и электрическом пол€х под действием электрического тока высокого напр€жени€. —войство катодных лучей приводить в движение тела и испытывать отклонени€ в магнитном и электрическом пол€х дало возможность сделать вывод, что это материальные частицы, несущие наименьший отрицательный зар€д.
¬ 1897 г. ƒж.“омсон (јнгли€) исследовал эти частицы и назвал их электронами. “ак как электроны могут быть получены независимо от вещества, из которого состо€т электроды, то это доказывает, что электроны вход€т в состав атомов любого элемента.
¬ 1896 г. ј. Ѕеккерель (‘ранци€) открыл €вление радиоактивности. ќн обнаружил, что соединени€ урана обладают способностью испускать невидимые лучи, действующие на фотографическую пластинку, завернутую в черную бумагу.
¬ 1898 г., продолжа€ исследовани€ Ѕеккерел€, ћ. юри-—кладовска€ и ѕ. юри открыли в урановой руде два новых элемента Црадий и полоний, обладающие очень большой активностью излучени€.

 + -
+ -
 β α
β α
 |  |

 |  |








 |
радиоактивный элемент
—войство атомов различных элементов самопроизвольно превращатьс€ в атомы других элементов, сопровождающеес€ испусканием альфа -, бета - и гамма Ц лучей, не видимых невооруженным глазом, называетс€ радиоактивностью.
—ледовательно, €вление радиоактивности €вл€етс€ пр€мым доказательством сложного строени€ атомов.
Ёлектроны €вл€ютс€ составной частью атомов всех элементов. Ќо электроны зар€жены отрицательно, а атом в целом электронейтрален, то, очевидно, внутри атома находитс€ положительно зар€женна€ часть, котора€ своим зар€дом компенсирует отрицательный зар€д электронов.
Ёкспериментальные данные о наличии положительно зар€женного €дра и его расположении в атоме были получены в 1911 г. Ё. –езерфордом (јнгли€), который предложил планетарную модель строени€ атома. —огласно этой модели атом состоит из положительно зар€женного €дра, очень малого по размерам. ¬ €дре сосредоточена почти вс€ масса атома. јтом в целом электронейтрален, следовательно, суммарный зар€д электронов должен быть равен зар€ду €дра.
»сследовани€ √. ћозли (јнгли€, 1913 г.) показали, что положительный зар€д атома численно равен пор€дковому номеру элемента в периодической системе ƒ.». ћенделеева.
»так, пор€дковый номер элемента указывает число положительных зар€дов €дра атома, а так же число движущихс€ в поле €дра электронов. ¬ этом заключаетс€ физический смысл пор€дкового номера элемента.
—огласно €дерной модели наиболее просто устроен атом водорода: €дро несет один элементарный положительный зар€д и массу, близкую к единице. ќно называетс€ протоном (Ђпростейшийї).
¬ 1932 г. физик ƒ.Ќ. „едвик (јнгли€) установил, что лучи, испускаемые при бомбардировке атома альфа-частицами, обладают огромной проницательной способностью и представл€ют собой поток электронейтральных частиц Ц нейтронов.
Ќа основании изучени€ €дерных реакций ƒ.ƒ. »ваненко (физик, ———–, 1932 г.) и одновременно ¬.√ейзенберг (√ермани€) сформулировали протонно-нейтронную теорию строени€ €дер атомов, согласно которой €дра атомов состо€т из положительно зар€женных частиц-протонов и нейтральных частиц-нейтронов (1–) - протон имеет относительную массу 1 и относительный зар€д + 1. 1
(1n) Ц нейтрон имеет относительную массу 1 и зар€д 0.
0
“аким образом, положительный зар€д €дра определ€етс€ числом протонов в нем и равен пор€дковому номеру элемента в ѕ—; массовое число Ц ј(относительна€ масса €дра) равно сумме протонов (Z) нейтронов (N):
|
|
|
A = Z + N; N = A- Z
»зотопы
јтомы одного элемента, имеющие одинаковый зар€д €дра и разное массовое число Ц изотопы. ” изотопов одного элемента одинаковое число протонов, но разное число нейтронов.
»зотопы водорода:
 |  |
1Ќ 2 Ќ 3Ќ 3 Ц массовое число
1 1 1 3Ќ
1
1 - зар€д €дра
протий дейтерий тритий
Z = 1 Z = 1 Z =1
N = 0 N = 1 N = 2
1протон 1 протон 1 протон
0 нейтронов 1 нейтрон 2 нейтрона
»зотопы одного элемента имеют одинаковые химические свойства и обозначаютс€ одним химическим символом, занимают одно место в ѕ.—. “ак как масса атома практически равна массе €дра (масса электронов ничтожно мала), то каждый изотоп элемента характеризуетс€, как и €дро, массовым числом, а элемент атомной массой. јтомна€ масса элемента Ц это среднее арифметическое между массовыми числами изотопов элемента с учетом процентного содержани€ каждого изотопа в природе.
ѕредложенна€ –езерфордом €дерна€ теори€ строени€ атома получила широкое распространение, но в дальнейшем исследователи натолкнулись на р€д принципиальных трудностей. —огласно классической электродинамике электрон должен излучать энергию и двигатьс€ не по окружности, а по спиралевидной кривой и в итоге упасть на €дро.
¬ 20 Ц х годах XX в. ученые установили, что электрон имеет двойственную природу, обладает свойствами волны и частицы.
ћасса электрона равна 1 ___ массы водорода, относительный зар€д
равен (-1). „исло электронов в атоме равно пор€дковому номеру элемента. Ёлектрон движетс€ по всему объему атома, создава€ электронное облако с неравномерной плотностью отрицательного зар€да.
ѕредставление о двойственной природе электрона привело к созданию квантово-механической теории строени€ атома (1913 г., датский ученый Ќ. Ѕор). √лавный тезис квантовой механики Ц микрочастицы имеют волновую природу, а волны Ц свойства частиц. вантова€ механика рассматривает веро€тность нахождени€ электрона в пространстве вокруг €дра. ќбласть наиболее веро€тного нахождени€ электрона в атоме (≈ 90%) называетс€ атомной орбиталью.
ѕрин€то изображать только границы этой области.
 |
, ∞
»сход€ из квантовой теории Ќ. Ѕор теоретически обосновал модель атома водорода.
¬ основу своей теории Ѕор положил следующие постулаты: электрон может двигатьс€ вокруг €дра атома не по любым орбитам, а только по вполне определенным, дозволенным.
—хемы атомов по Ѕору:
1Ќ 2He 3 Li 11Na
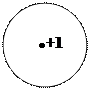 |  | ||||||
 | |||||||
 | |||||||


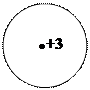
аждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое €вл€етс€ совокупностью различных положений быстро движущегос€ электрона.
’имические свойства элементов определ€ютс€ строением электронных оболочек их атомов.
вантовые числа. ѕринцип ѕаули.
ќсновной характеристикой электрона в атоме €вл€етс€ энерги€ электрона. —осто€ние электрона в атоме (энерги€ электрона, электронна€ орбиталь) характеризуют набором квантовых чисел.
√лавное квантовое число Ђnї характеризует энергию электрона на данном уровне и размер электронных орбиталей данного уровн€.
¬еличина Ђnї соответствует номеру энергетического уровн€ и принимает значени€ целых чисел от 1 до ∞ (бесконечности):
n= 1,2,3,4,5,6,7Е..∞
ќрбитали, которые имеют одинаковой значение Ђnї, близки между собой по энергии и по размеру.
|
|
|
—овокупность орбиталей, которые имеют одинаковое значение главного квантового числа составл€ют энергетический уровень.
оличество энергетических уровней в атоме равно номеру периода ѕ.—., в котором находитс€ элемент. ћаксимальное число электронов на уровне определ€етс€ по формуле 2n 2 , где Ц номер уровн€, значение главного квантового числа. ”ровни прин€то обозначать цифрами или буквами:
K L M N O P Q
n=1 n=2 n=3 n=4 n =5 n=6 n=7
max e 2 8 18 32
 |
энерги€ и размер орбиталей увеличиваетс€
Ќаименьшей энергией обладает 1-ый уровень от €дра, наибольшейЦ последний уровень. –аспредел€ют электроны по уровн€м, начина€ с 1-го уровн€. «авершенный уровень имеет максимальное число электронов. Ќа последнем уровне не может быть более 8 электронов. —овокупность электронов, которые наход€тс€ на одном электрическом уровне Ц электронный слой.
ѕример: –аспределить по уровн€м электроны атома серы.
—ера находитс€ в III периоде, следовательно, имеет 3 уровн€; пор€дковый номер серы 16, следовательно, имеет 16 е.
16S K L M
n=1 n=2 n=3
2 8 6
Ќа одном энергетическом уровне могут находитьс€ орбитали (электронные облака), которые имеют различные геометрические формы.
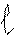
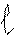
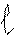
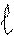 ‘орма орбиталей и облаков характеризуетс€ орбитальным (побочным) квантовым числом (), а также характеризует энергию электрона на данном подуровне. Ќа уровне Ђnї орбитальное квантовое число принимает значени€ целых чисел от 0 до (n Ц 1). аждому значению электрона соответствует определенна€ форма электронной орбитали, которую прин€то обозначать буквами (s, p, d, f) и называть подуровн€ми. ќрбитали, дл€ которых = 0, имеют форму шара и называютс€ s Ц орбитал€ми, дл€ которых = 1, имеют форму объемной восьмерки и называютс€ p- орбитал€ми. ќрбитали с большими значени€ми
‘орма орбиталей и облаков характеризуетс€ орбитальным (побочным) квантовым числом (), а также характеризует энергию электрона на данном подуровне. Ќа уровне Ђnї орбитальное квантовое число принимает значени€ целых чисел от 0 до (n Ц 1). аждому значению электрона соответствует определенна€ форма электронной орбитали, которую прин€то обозначать буквами (s, p, d, f) и называть подуровн€ми. ќрбитали, дл€ которых = 0, имеют форму шара и называютс€ s Ц орбитал€ми, дл€ которых = 1, имеют форму объемной восьмерки и называютс€ p- орбитал€ми. ќрбитали с большими значени€ми
»меют сложную форму
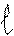 | 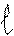 | 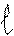 | 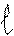 |
= 0 = 1 = 2 = 3
 | |||||
 | |||||
 | |||||







S p d f
„исло подуровней на уровне равно номеру уровн€
номер уровн€ n = 1 n = 2 n = 3
s число подуровней 1 s 2 s2p 3s3p3d
÷ифра перед подуровнем обозначает номер уровн€.
d- орбитали есть на всех энергетических уровн€х, кроме первого (K) и второго (L) уровней.
f Ц орбитали есть на всех энергетических уровн€х, кроме первого (K), второго (L) и третьего (M) уровней.
„исло электронов на подуровне указывают в виде степени буквенного обозначени€. ћаксимальное число электронов на подуровн€х следующее: s 2, p6, d 10, f 14


 Ёнерги€ орбиталей (E), которые наход€тс€ на одном энергетическом уровне, но имеют различную форму, неодинакова. Ќа уровне энерги€ подуровн€ увеличиваетс€ от Es Ep Ed Ef
Ёнерги€ орбиталей (E), которые наход€тс€ на одном энергетическом уровне, но имеют различную форму, неодинакова. Ќа уровне энерги€ подуровн€ увеличиваетс€ от Es Ep Ed Ef
Ёнергетические уровни состо€т из энергетических подуровней.
Ёнергетический подуровень Ц это совокупность орбиталей, которые наход€тс€ на одном энергетическом уровне и имеют одинаковую форму.
 «начит, орбитали одного подуровн€ имеют одинаковые значени€ главного квантового числа (n) и одинаковые значени€ побочного квантового числа ().
«начит, орбитали одного подуровн€ имеют одинаковые значени€ главного квантового числа (n) и одинаковые значени€ побочного квантового числа ().
ѕример: –аспределить электроны атома серы по подуровн€м.
16S K L M
n=1 n=2 n=3 по уровн€м
2 8 6
 |  |  |
1s2 2s22p6 3s23p43d по подуровн€м






