Формировании третичной структуры. Супервторичная структура. Доменная структура и
Ее роль в функционировании белков. Роль шаперонов (белки теплового шока) в
Формировании третичной структуры белков in vivo.
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу
Супервторичная структура - это более высокий уровень организации белковой молекулы, представленный ансамблем взаимодействующих между собой вторичных структур
Некоторый специфический порядок чередования вторичных структур наблюдается во многих разных по структуре и функциям белках и носит название супервторичной структуры.
Такие упорядоченные структуры часто обозначают как структурные мотивы, которые имеют специфические названия: «а-спираль—поворот—а-спи-раль», «лейциновая застежка-молния», «цинковые пальцы», «структура Р-бочонка» и др.
По наличию а-спиралей и b-структур глобулярные белки могут быть разделены на 4 категории:
1.В первую категорию включены белки, в которых имеются только а-спирали, например миоглобин и гемоглобин.
2. Во вторую категорию включены белки, в которых имеются а-спирали и b-структуры. ЛДГ.
3. В третью категорию включены белки, имеющие только вторичную b-структуру. Такие структуры обнаружены в иммуноглобулинах, в ферменте супероксиддисмутазе
4. В четвертую категорию включены белки, имеющие в своем составе лишь незначительное количество регулярных вторичных структур. К таким белкам можно отнести небольшие богатые цистином белки или металлопротеины.
В ДНК-связывающих белках имеются общие виды супервторичных структур: «спираль—поворот—спираль», «лейциновая застежка-молния», «цинковые пальцы». ДНК-связывающие белки содержат центр связывания, комплементарный участку ДНК с определенной нуклеотидной последовательностью. Эти белки участвуют в регуляции действия генов.
«а- Спираль—поворот—а-спираль»
3 Вопрос
Под термином «общий белок сыворотки крови» или «общий белок крови» понимается большое количество белков, присутствующих в сыворотке крови и различающихся между собой по структуре, физико-химическим свойствам, функции. Все белки сыворотки крови делят на альбумин и глобулины. В плазме крови помимо альбумина и глобулинов содержится также фибриноген, поэтому содержание общего белка в плазме крови несколько выше, чем в сыворотке.
Нормальные значения общего белка сыворотки крови
В норме содержание общего белка в сыворотке крови составляет у новорожденного до 1 мес — 46,0 — 68,0 г/л, уровень белка в сыворотке у недоношенных может быть намного ниже, чем у доношенных, - в пределах от 36 до 60 г/л, уровень общего белка сыворотки у детей в возрасте 1 — 12 мес — 48,0 — 76,0 г/л, у детей 1 — 16 лет — 60,0 — 80,0 г/л, у взрослых — 65,0 — 85,0 г/л. После 60 лет уровень общего белка в сыворотке крови ниже приблизительно на 2 г/л.
Клиническое значение определения общего белка сыворотки крови
Общий белок сыворотки крови является лабораторным показателем, отражающим состояние гомеостаза. Белки сыворотки крови играют очень важную и многообразную роль. Благодаря им поддерживается вязкость и текучесть крови и формируется ее объем в сосудистом русле, а концентрация белка обеспечивает плотность плазмы крови, что позволяет форменным элементам удерживаться во взвешенном состоянии. Белки сыворотки крови осуществляют транспортные (связывание гормонов, минеральных компонентов, липидов, пигментов и т. п.) и защитные (иммуноглобулины, опсонины, белки острой фазы и др.) функции, участвуют в регуляции кислотно-щелочного состояния организма, являются регуляторами свертываемости крови и антителами. Поэтому содержание общего белка является очень важным диагностическим параметром при целом ряде заболеваний, особенно связанных с выраженными нарушениями метаболизма.
В клинической практике довольно часто встречаются состояния, характеризующиеся изменением концентрации общего белка сыворотки крови. Увеличение концентрации общего белка в сыворотке крови носит название гиперпротеинемии, а снижение — гипопротеинемии.
Гиперпротеинемия
Увеличение общего белка в сыворотке крови может быть относительным и абсолютным.
Относительная гиперпротеинемия связана с уменьшением содержания воды в сосудистом русле, к чему могут приводить следующие состояния:
· тяжелые ожоги;
· генерализованный перитонит;
· непроходимость кишечника;
· неукротимая рвота;
· профузный понос;
· несахарный диабет;
· хронический нефрит;
· усиленное потоотделение;
· диабетический кетоацидоз.
Абсолютная гиперпротеинемия встречается редко. При этом увеличение общего белка в сыворотке крови может быть связано с синтезом патологических белков (парапротеинов), повышением синтеза иммуноглобулинов или усиленном синтезе белков острой фазы воспаления. Абсолютная гиперпротеинемия наблюдается при следующих заболеваниях:
· парапротеинемических гемобластозах (миеломная болезнь, болезнь Вальденстрема, болезнь тяжелых цепей) — отмечается значительное — до 120 — 160 г/л - возрастание концентрации общего белка;
· болезни Ходжкина;
· хроническом полиартрите;
· активном хроническом гепатите;
· острых и хронических инфекциях;
· аутоиммунных заболеваниях;
· саркоидозе;
· циррозе печени без выраженной печеночно-клеточной недостаточности.
Гипопротеинемия
Снижение концентрации общего белка в сыворотке крови также может быть относительным и абсолютным.
Относительная гипопротеинемия, как правило, связана с увеличением объема воды в кровеносном русле и наблюдается при следующих состояниях:
· водной нагрузке («водном отравлении»);
· прекращении отделения мочи (анурии);
· уменьшении диуреза (олигурии);
· внутривенном введении больших количеств раствора глюкозы больным с нарушенной выделительной функцией почек;
· сердечной декомпенсации;
· повышенной секреции в кровь антидиуретического гормона гипоталамуса - гормона, способствующего задержке воды в организме.
Абсолютная гипопротеинемия, как правило, связана с гипоальбуминемией. При этом уменьшение концентрации общего белка в сыворотке крови возникает при:
· недостаточном поступлении белка в организм (голодание, недоедание, сужение пищевода, нарушение функции желудочно-кишечного тракта, например, воспалительного характера — энтериты, энтероколиты и др.);
· подавлении биосинтеза белка, сопровождающем хронические воспалительные процессы в печени (гепатиты, циррозы печени, интоксикации, атрофия печени);
· врожденных нарушениях синтеза отдельных белков крови (анальбуминемия, болезнь Вильсона-Коновалова, другие дефектопротеинемии — значительно более редко);
· повышенном распаде белка в организме (злокачественные новообразования, обширные ожоги, гиперфункция щитовидной железы (тиреотоксикоз), состояния после операции, длительная лихорадка, травмы, длительное лечение кортикостероидами);
· повышенной потере белка (нефротический синдром, гломерулонефрит, сахарный диабет, длительный (хронический) понос, кровотечения);
· перемещении белка в «третьи» пространства (асцит, плеврит).
Уменьшение концентрации общего белка в сыворотке крови отмечается и при некоторых физиологических состояниях, например, при длительной физической нагрузке, у женщин в последние месяцы беременности и в период лактации.
На уровень общего белка в сыворотке крови может оказывать влияние прием некоторых лекарственных препаратов. Так, например, кортикотропин, кортикостероиды, мисклерон, бромсульфалеин и клофибрат способствуют повышению концентрации общего белка в сыворотке, а пиразинамид, эстрогены — его снижению.
На степень концентрации общего белка может оказывать влияние и положение тела: при изменении горизонтального положения тела на вертикальное концентрация общего белка повышается приблизительно на 10% в течение 30 минут.
Пережатие сосудов во время взятия крови и «работа рукой» также могут привести к возрастанию концентрации общего белка в сыворотке крови.
При интерпретации результатов определения общего белка сыворотки крови необходимо учитывать значение гематокрита — в ряде случаев это помогает отличить относительное изменение общего белка от абсолютного, а следовательно, правильно поставить диагноз и определиться с тактикой лечения.
4 вопрос
Ферменты – это глобулярные белки, состоящие из одной или нескольких полипептидных цепей, организованных в 3-х мерную структуру.
По химическому строению различают простые (однокомпонентные) ферменты (состоят только из аминокислот) и сложные двукомпонентные ферменты (имеющие небелковую часть - кофактор).
Кофакторы – это вещества, способствующие действию ферментов, или необходимые для его осуществления. Роль кофактора в основном сводится к следующему:
· изменение третичной структуры белка и создание комплементарности между ферментом и субстратом, стабилизация молекулы фермента в пространстве;
· непосредственное участие в реакции в качестве еще одного субстрата.
Кофакторы делят, хотя и достаточно условно, на коферменты и простетические группы.
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
По строению ферменты делятся на простые (однокомпонентные) и сложные (двукомпонентные). Простой состоит только из белковой части, сложный (холофермент) – из белковой и небелковой частей. Белковая часть – апофермент, небелковая – кофермент (витамины В1, В2, В5, В6, Н, Q и др.). Отдельно апофермент и кофермент не обладают каталитической активностью. Участок на поверхности молекулы фермента, который взаимодействует с молекулой субстрата – активный центр.
Активный центр образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных сближенных полипептидных цепей. Образуется на уровне третичной структуры белка-фермента. В его пределах различают субстратный (адсорбционный) центр и каталитический центр. Кроме активного центра встречаются особые функциональные участки – аллостерические (регуляторные) центры.
Каталитический центр - это область активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. КЦ простых ферментов – это сочетание нескольких аминокислотных остатков, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи (серин, цистеин, тирозин, гистидин, аргинин, асп. и глут. кислоты). КЦ сложного белка устроен сложнее, т.к. участвует простетическая группа фермента – кофермент (водорастворимые витамины и жирорастворимый витамин K).
5 вопрос

Глюкозо-лактатный цикл (цикл Кори) – это связь глюконеогенеза в печени и образования лактата эритроцитах или мышцах из глюкозы. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах накопление лактата является следствием гликолиза при очень интенсивной, максимальной мощности, работе, и чем более такая работа интенсивна, тем менее продолжительна После нагрузки (во время восстановления) лактат удаляется из мышцы довольно быстро – всего за 0,5‑1,5 часа.
 Дополнение
Дополнение
Следует отметить, что если продолжительность нагрузки мала (до 10 секунд), то количество АТФ пополняется преимущественно в креатинфосфокиназной реакции. В таком режиме к примеру работают мышцы у ттангистов, прыгунов как в длину, так и в высоту, метателей молота, копья и т.п.. Если нагрузка не более 90 секунд – АТФ синтезируется в основном в реакциях анаэробного гликолиза. В спорте это бегуны-спринтеры на 100-500 м, спортсмены силовых видов (борцы, тяжелоатлеты, бодибилдеры). Если напряжение мышцы длится более двух минут – развивается аэробное окисление глюкозы в реакциях ЦТК и дыхательной цепи.
Но, хотя мы и говорим об аэробном окислении глюкозы, необходимо знать и помнить, что лактат образуется в мышце всегда: и при анаэробной, и при аэробной работе, однако в разных количествах.
Образовавшийся лактат может утилизоваться только одним способом – превратиться в пировиноградную кислоту. Но, как уже указывалось, пируват токсичен для клеток и должен быть как можно быстрее утилизован. Сама мышца ни при работе, ни во время отдыха не занимается превращением лактата в пируват из-за наличия специфического изофермента ЛДГ‑5.
Если молочная кислота поступила в миокардиоциты, она быстро превращается в пируват, далее в ацетил-S‑КоА и вовлекается в полное окисление до СОB2B и НB2BО.
Большая часть лактата захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза.
Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты рансаминируются с a-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой и пирувата и азота из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы
Глюкоза, образованная в печени из лактата или аланина, возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.

6 вопрос
Аммиак образуется в результате дезаминирования глутамата, биогенных аминов, нуклеотидов (рис.16). Часть аммиака образуется в кишечнике в результате действия бактерий (гниение белков в кишечнике). Образование аммиака происходит во всех клетках, а процессы его окончательного обезвреживания – в печени и почках. Аммиак – токсичное соединение (в первую очередь для ЦНС). Низкая концентрация аммиака в крови свидетельствует о том, что в клетках происходит связывание аммиака (первичное обезвреживание) с образованием нетоксичных соединений (транспортных форм) в виде которых аммиак доставляется в печень и почки для окончательного обезвреживания.
Основным путем первичного обезвреживания аммиака является образование амидов – глутамина и аспарагина. Глутамин образуется под действием глутаминсинтетазы, при этом затрачивается молекула АТФ. Аспарагин образуется под действием аспарагинсинтетазы, при этом также затрачивается молекула АТФ, но она расщепляется до АМФ.
В мозге и некоторых других тканях аммиак связывается в результате восстановительного аминирования под действием глутаматдегидрогеназы.
В печени и почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Аммиак, соединяясь с кислотами, выводится в виде солей аммония с мочой (0,5 г в сутки). Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Синтез глутаминазы повышается при ацидозе, образующийся при этом аммиак нейтрализует кислые продукты обмена. Эта реакция защищает организм от излишней потери ионов Nа+ и К+, которые также могут использоваться для выведения анионов кислот и утрачиваться.
В печени аммиак обезвреживается путем синтеза мочевины. Мочевина – нетоксичный, водорастворимый конечный продукт азотистого обмена, выводимый почками. За сутки с мочой выделяется около 25 г мочевины. При повышении количества потребляемого с пищей белка выделение мочевины увеличивается. Синтез мочевины (орнитиновый цикл) происходит только в печени
Мочевина – полный амид угольной кислоты (карбамид) – содержит 2 атома азота. Источником одного из них является аммиак, который связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Далее карбамоильная группа карбамоилфосфата переносится на орнитин с образованием цитруллина. В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат. Аспартат является источником второго атома азота мочевины. Далее аргининосукцинат расщепляется на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. Аргинин подвергается гидролизу под действием аргиназы, в результате чего образуется орнитин и мочевина.
Нарушение реакций обезвреживания аммиака может вызвать повышение концентрации аммиака в крови – гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетические дефекты ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита. К симптомам гипераммониемии относят тремор, тошноту, рвоту, нечленораздельную речь, головокружение, судороги, потерю сознания. В тяжелых случаях может развиться кома с летальным исходом
Вопр 7
Витамин А (ретинол)– зрительный процесс (регулирует рост и дифференцировку клеток)
Витамин А
Ретинол
Антиксерофтальмический
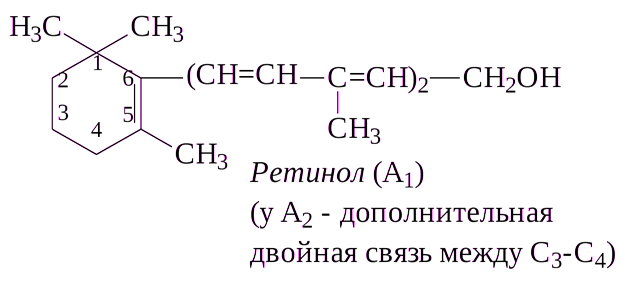
В продуктах витамин АРыбий жир, печень рыб, птиц и животных, желток куриного яйца, сливочное масло, зелень, красно-мякотные овощи
Проявление недостатка витамина А Куриная слепота
Витамин А (ретинол; антиксерофтальмический витамин) хорошо изучен. Известны три витамина группы А: А1, А2 и цис- форма витамина А1, названная неовитамином А. С химической точки зрения ретинол представляет собой циклический непредельный одноатомный спирт, состоящий из шестичленного кольца (β-ионон), двух остатков изопрена и первичной спиртовой группы.

Витамин А2 отличается от витамина А1 наличием дополнительной двойной связи в кольце β-ионона. Все 3 формы витаминов группы А существуют в виде стереоизомеров, однако только некоторые из них обладают биологической активностью. Витамины группы А хорошо растворимы в жирах и жирорастворителях: бензоле, хлороформе, эфире, ацетоне и др. В организме они легко окисляются при участии специфических ферментов с образованием соответствующих цис- и транс- альдегидов, получивших название ретиненов (ретинали), т.е. альдегидов витамина А; могут откладываться в печени в форме более устойчивых сложных эфиров с уксусной или пальмитиновой кислотой.
Характерными симптомами недостаточности витамина А у человека и животных являются торможение роста, снижение массы тела, общее истощение организма, специфические поражения кожи, слизистых оболочек и глаз. Прежде всего, поражается эпителий кожи, что проявляется пролиферацией и патологическим ороговением его; процесс сопровождается развитием фолликулярного гиперкератоза, кожа усиленно шелушится, становится сухой. В результате начинаются вторичные гнойные и гнилостные процессы. При авитаминозе А поражается также эпителий слизистой оболочки всего пищеварительного тракта, мочеполового и дыхательного аппаратов. Характерно поражение глазного яблока – ксерофтальмия, т.е. развитие сухости роговой оболочки глаза (от греч. xeros – сухой, ophthalmos – глаз) вследствие закупорки слезного канала, эпителий которого также подвергается ороговению. Глазное яблоко не омывается слезной жидкостью, которая, как известно, обладает бактерицидным свойством. В результате этого развиваются воспаления конъюнктивы, отек, изъязвление и размягчение роговицы. Распад и размягчение роговицы связаны с развитием гнойного процесса, поскольку гнилостные микроорганизмы при отсутствии слезной жидкости быстро развиваются на поверхности роговицы.
К наиболее ранним и специфическим симптомам авитаминоза А (гиповитаминоза А) относится куриная, или ночная, слепота (гемералопия). Она выражается в потере остроты зрения, точнее, способности различать предметы в сумерках, хотя больные днем видят нормально.
Помимо гипо- и авитаминозов, описаны случаи гипервитаминоза Апри употреблении в пищу печени белого медведя, тюленя, моржа, в которой содержится много свободного витамина А. Характерны проявления гипервитаминоза А: воспаление глаз, гиперкератоз, выпадение волос, общее истощение организма. При этом, как правило, отмечаются потеря аппетита, головные боли, диспепсические явления (тошнота, рвота), бессонница. Гипервитаминоз может развиться и у детей, в результате приема больших количеств рыбьего жира и препаратов витамина А. Описан острый гипервитаминоз у детей после приема больших доз витамина А, при этом повышается его содержание в крови.
Биологическая роль. Витамин А оказывает влияние на барьерную функцию кожи, слизистых оболочек, проницаемость клеточных мембран и биосинтез их компонентов, в частности определенных гликопротеинов. Существует предположение, что благодаря наличию двойных связей в молекуле витамин А может участвовать в окислительно-восстановительных реакциях, поскольку он способен образовывать перекиси, которые в свою очередь повышают скорость окисления других соединений.
Более подробно выяснено значение витамина А в процессе светоощущения. В этом важном физиологическом процессе большую роль играет особый хромолипопротеин – сложный белок родопсин, или зрительный пурпур, являющийся основным светочувствительным пигментом сетчатки, в частности палочек, занимающих ее периферическую часть. Установлено, что родопсин состоит из липопротеина опсина и простетической группы, представленной альдегидом витамина A1 (ретиналь); связь между ними осуществляется через альдегидную группу витамина и свободную ε-NH2-группу лизина молекулы белка с образованием шиффова основания. На свету родопсин расщепляется на белок опсин и ретиналь; последний подвергается серии конформационных изменений и превращению в транс- форму. С этими превращениями каким-то образом связана трансформация энергии световых лучей в зрительное возбуждение – процесс, молекулярный механизм которого до сих пор остается загадкой. В темноте происходит обратный процесс – синтез родопсина, требующий наличия активной формы альдегида – 11 -цис- ретиналя, который может синтезироваться из цис- ретинола, или транс- ретиналя, или транс -формы витамина А при участии двух специфических ферментов – дегидрогеназы и изомеразы. Более подробно цикл превращений родопсина в сетчатке глаза на свету и в темноте можно представить в виде схемы:

Рисунок 25- Цикл превращений родопсина в сетчатке глаза на свету и в темноте
Таким образом, под действием кванта света, родопсин через ряд промежуточных продуктов («оранжевый» и «желтый» белки) распадается на опсин и алло- транс- ретиналь, представляющий собой неактивную форму альдегида витамина А. Имеются сведения, что алло- транс -ретиналь может частично превращаться в активный 11- цис -ретиналь под влиянием света (на схеме – пунктирная стрелка). Однако главным путем образования 11- цис- ретиналя является ферментативное превращение транс -формы витамина А в цис -форму (под действием изомеразы) и последующее окисление ее при участии алкогольдегидрогеназы.
Распространение в природе и суточная потребность. Витамин А широко распространен. Наиболее богаты этим витамином следующие продукты животного происхождения: печень крупного рогатого скота и свиней, яичный желток, цельное молоко, масло, сметана, сливки. Особенно много свободного витамина А в жирах печени морского окуня, трески, палтуса: в частности, в жире печени морского окуня содержание витамина А доходит до 35%. Источниками витамина А для человека являются также красно-мякотные овощи (морковь, томаты, перец и др.), в которых витамин А содержится в виде провитаминов – каротинов, выделенных впервые из моркови (от лат. carota – морковь). Известны 3 типа каротинов: α-, β- и γ-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает β-каротин, при распаде в организме из него образуются две молекулы витамина А.

При окислительном распаде α- и γ-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному β-иононовому кольцу. Расщепление каротинов на молекулы витамина А происходит преимущественно в кишечнике под действием специфического фермента β-каротиндиоксигеназы (не исключена возможность аналогичного превращения и в печени) в присутствии молекулярного кислорода. При этом образуются 2 молекулы ретиналя, которые под действием специфической кишечной редуктазы восстанавливаются в витамин А. Степень усвоения каротинов и свободного витамина А зависит как от содержания жиров в пище, так и от наличия свободных желчных кислот, являющихся абсолютно необходимыми соединениями для процесса всасывания продуктов распада жиров.
Суточная потребность для взрослого человека составляет в среднем 2,7 мг витамина А или от 2 до 5 мг β-каротина. У человека основным органом, в котором частично откладывается про запас витамин А, является печень. В норме в ней содержится около 20 мг этого витамина на 100 г ткани.
8 вопр
Йодтиронин: при гипофункции у детей развивается кретинизм. Симптомы карликовый рост, но нарушено пропорциональное телосложение (короткие ноги и руки, старческий вид, тяжелая умственная отсталость, замедленная речь.). Гипофункция у взрослых приводит к развитию мексидемы (слизистый отек). У больных замедленная психическая деятельность, ожирение, вылость, апатия, кожа холодная, жесткая, отечная.
Гиперфункция (Гипертиреоидизм) – базедова болезнь. Проявляется повышенной психической деятельностью, нервной возбудимостью, сменой настроения, слезливость, тахикардия, тремором пальцев рук и век, потливостью, повышение температуры тела, пучеглазие, исхудание при повышенном питании, волнообразное прилив тепла, увеличение железы (зоб).
В местностях с низким содержанием йода в почве, а следовательно в воде развивается эндемический зоб,т.е. увеличение щитовидной железы, как компенсаторная реакция железы на недостаток йода.При этом может быть нормальная функция, гипофункция и гиперфункция.Профилактика это йодированная соль.
Химическое строение: в фолликулах щитовидной железы содержится коллоид, в котором есть сложный белок тироглобулин с молекулярной массой = 660000 из него образуется гормоны йодтиронины: тироксин – тертайодтиронин (3,5,3’,5’) (Т4).
В последние годы выделен 3,3’,5’ реверсированный трийодтиронин (rТ3) – не обладает энергетическим эффектом.
Синтез гормона: йод поступает в организм с водой и продуктами в виде неорганических и органических солей (йодиды). Они транспортируются кровью и щитовидная железа извлекает из крови йодиды в железе фермент йодидпероксидазы окисляет йодид в йодинид
- e - e
J –––→ J0 ––→ J+
И он вкючается в остатке тирозина (йодирование) в тироглобулине ферментом тирозинйодиназой моно и дийодтирозин в тироглобулине соединяется под действием гормона гипофиза тиротропина. Тироглобулин из фолликулов переносит в эпителиальные клетки. В них протеолитические ферменты лизосом расщепляют тироглобулин с образованием тетра, три, ди, монойодтиронинов. Ди и монойодтирозинов. Гормонами из них являются только Т3 и Т4. все они поступают в кровь и ди- и монойодтиронины и ди- и монойодтирозины дейодируются ферментом дейоддазой и йод снова захватывает железа.
Гормоны связываются с белками крови альбуминами и α1, α2 – глобулинами.
Биологическое действие: гормоны относится к проникающим в клетку. Мешенями являются мышцы, печень, почки, сердце, жировая ткань, нервная ткань.
В печени Т4 дейодируется и превращается в Т3, который является активной формой гормона.В тканях влияет на свойства мембран – проницаемость, возбудимость, величину электрического потенциала.
Стимулирует деление клеток, дифференцировку тканей (при гипофункции у детей нарушена дифференцировка нейронов, поэтому кретинизм) в норме гормон Т3 стимулирует транскрипцию гена СТГ и усиливает его секрецию.
Влияние на обмен углеводов: повышает содержание сахара в крови, стимулирует синтез ферментов распада углеводов, ингибирует фосфодиэстеразу и увеличивают концентрацию ц-АМФ, поэтому стимулируется распад и тормозится синтез глюкогона.
Влияние на обмен липидов: гормоны стимулируют липолиз по этому же механизму.
Влияние на обмен белков: зависимость от дозы гормона и возраста. В детском возрасте малые дозы гормона стимулирует синтез белков, проявляют анаболическое действие. Большие дозы вызывают распад белков, т.е. катаболическое действие.
Влияние на вводно-солевой обмен: т.е. распределение воды между кровью, межклеточным пространствам и клетками.
Влияние на энергообмен: стимулирует распад углеводов, липидов, окислительные процессы. Большие дозы гормонов являются протонофорами. Протонофорами являются так же жирные кислоты, которые образуются при липолизе.
Эти гормоны участвуют в терморегуляции организма как разобщители окисления и фосфорелирования.
9 вопрос
Дело в том, что спринтеры, стайеры отличаются друг от друга по особенностям структуры мышечных волокон. Возьмем, к примеру, бегуна, который работает с короткими дистанциями. Его мышечная система представлена белыми волокнами. Одна из особенностей таких является быстрое сокращение. В основе сокращения лежат анаэробные процессы, не требующие кислород. Ярким примером служат результаты исследования К. Льюиса. Этот спортсмен приходил первым к финишу на 6-и олимпиадах. В структуре мышечного аппарата ног бегуна 70% приходилось на рассматриваемый нами тип волокон. Шестикратный чемпион поразил своим рекордом — 45 км/ч. С Льюисом могут могли бы потягаться Б. Джонсон, Дж. Хайнс, И. Чиди, В. Брызгин, В. Борзов. Эти бегуны в свое время покрыли 100 м за 9,83, 9,95, 10, 10,03, 10,07, соответственно. В то же время анаэробные реакции в пределах небольшой дистанции повышают концентрацию молочной кислоты до уровня, при котором резко сбивается темп бега.
Что касается бегунов, которые освоили длинные дистанции, то они отличаются высоким удельным весом медленно сокращающихся волокон, которые также называются красными, аэробными. При их сокращении не вырабатывается молочная кислота. Перед финишем у спортсменов с такими мышцами появляется дополнительная энергия для рывка. Нередко марафонцы не доходят до финиша. Причина – раннее ускорение и повышение концентрации молочной кислоты.ение концентрации молочной кислоты.
2 разных типа бегуна отличаются не только техникой и тактикой бега и длиной дистанций. Существует и ряд физиологических отличий. Это и определяет, какие дистанции будут в большей степени удаваться человеку. Сильно заблуждаются те, кто думает: «Если спортсмен отлично бегает 1500 м или 3000 м, то он и стометровку легко пробежит, дистанция-то меньше». 100 м стайеры обычно бегают не очень хорошо.
У спринтеров лучше работают быстрые волокна, которым не нужен кислород для проведения метаболических процессов. Это анаэробная нагрузка. Мускулатура работает быстро и эффективно, но скоро утомляется, т. к. при отсутствии кислорода быстро расходуется запас энергии. Стайер – это тот, у кого включаются медленные волокна, где метаболизм проводится дольше. Плюс для окислительно-восстановительных процессов задействуется кислород. Организм испытывает аэробную нагрузку. Расход энергии получается ниже, но и скорость меньше.
Дело в том, что во время выполнения интенсивных упражнений мышцы человека испытывают острую нехватку кислорода, поэтому имеющиеся в организме углеводы расщепляются без его участия. Вырабатывается молочная кислота – продукт распада глюкозы. Чувство усталости появляется тогда, когда в крови уже достаточно накопилось молочной кислоты, поэтому анаэробные нагрузки считаются кратковременными. Однако постепенно человеческий организм приспосабливается и уже легче воспринимает накапливающуюся молочную кислоту. Время тренировок увеличивается, а человек уже не так быстро чувствует усталость. Анаэробные упражнения способствуют интенсивному использованию энергии мышц за короткий промежуток времени. Именно благодаря этому происходит укрепление мускулатуры, а также улучшение работы сердечно-сосудистой и дыхательной систем. Благодаря таким тренировкам со временем человек может увеличить способность своего организма противостоять накоплению токсинов и ускорять их выведение. Можно смело говорить о том, что у людей, для которых анаэробная тренировка стала привычным занятием, увеличивается выносливость, и они намного успешнее других могут бороться с усталостью. Не удивительно, что такие занятия помогают в борьбе с лишним весом – ведь увеличивается и укрепляется мышечная масса, значит, нет места жиру. Анаэробные нагрузки в первую очередь следует выполнять тем, кто хочет увеличить свою силу. В целом они полезны для любого человека – ведь кто не мечтает быть более выносливым и не так быстро уставать? Но прежде, чем приступить к таким тренировкам, необходимо знать несколько






