Классификация, изомерия, номенклатура
Различают два вида галогенопроизводных ароматических углеводородов.
1.Вид соединения галогена с углеродом ароматического кольца
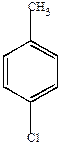
а) Моногалогенопроизводные

| 
| 
| 
|
| хлорбензол | о-хлортолуол | м-хлортолуол | п-хлортолуол |
б) Полигалогенопроизводные

| 
| 
| 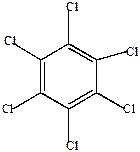
|
| о-дихлорбензол | м-дихлорбензол | п-дихлорбензол | гексахлорбензол |
2.Вид соединения галогена с углеродом боковой цепи.
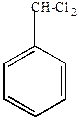
а) моногалогенпроизводные

хлористый бензил
б) полигалогенпроизводные
| 
|
| хлористый бензилиден | бензотрихлорид |
Получение
1.Действие галогенов на ароматические углеводороды (см.свойства ароматических углеводородов, реакции электрофильного замещения);
2. Из первичных ароматических аминов через соли диазония.
CuCl
C6H5NH2 + O=N-OH + HHal  C6H5N2Hal
C6H5N2Hal 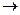 C6H5Hal + N2
C6H5Hal + N2
-2H2O
(подробнее см.получение и свойства ароматических диазосоединений).
3. Получение соединений с галогеном в боковой цепи.
а) реакция хлорметилирования

| + | 
| ZnCl2
+ HCl 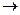 -H2O
-H2O
| 
|
| формальдегид | хлористый водород | хлористый бензил |
б) замещение группы ОН в ароматических спиртах на галоген
C6H5CH2OH + HCl 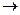 C6H5CH2Cl
C6H5CH2Cl
-H2O
хлористый бензил
Физические свойства галогенопроизводных ароматических углеводородов
Жидкости или твердые вещества, практически нерастворимы в воде. Плотность больше 1. Соединения с Hal в боковой цепи обладают раздражающим запахом и слезоточивым действием.
Химические свойства
Галогенопроизводные ароматических углеводородов обладают в основном теми же свойствами, что и галогенопроизводные жирного ряда, но отличаются различной активностью в реакциях нуклеофильного замещения атома галогена.
а) соединения 1 типа (галоген связан с углеродом ядра) вступают в реакции нуклеофильного замещения галогена с большим трудом. Так, реакция гидролиза хлорбензола протекает под действием водного раствора щелочи лишь при 300-3500С, под давлением и в присутствии катализатора – мелко раздробленной меди.

| 300-3500C
P, Cu
+ NaOH 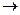 NaCl + NaCl +
| 
|
Причиной является наличие эффекта р-  -сопряжения неподеленной пары электронов хлора и
-сопряжения неподеленной пары электронов хлора и  -электронов кольца. Благодаря этому уменьшается полярность связи С-Cl, уменьшается положительный заряд у углерода, что затрудняет атаку нуклеофильного реагента.
-электронов кольца. Благодаря этому уменьшается полярность связи С-Cl, уменьшается положительный заряд у углерода, что затрудняет атаку нуклеофильного реагента.

Подвижность хлора может быть увеличена, если в о- или п-положение к Hal ввести нитрогруппу, т.к. электроноакцепторная нитрогруппа способствует увеличению +  у углерода, связанного с галогеном.
у углерода, связанного с галогеном.
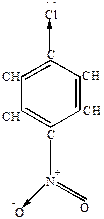
Замещение Hal в ядре идет по механизму SN2 через промежуточную стадию образования дегидробензола.

|
+ NaOH  -NaCl
-H2O
-NaCl
-H2O
| 
|
 HOH HOH
|  
| 
|
| п-хлортолуол | дегидротолуол | м-крезол, 50% | |||

| 
| ||||
| п-крезол |
б) Галогенопроизводные с галогеном в боковой цепи (у  -углеродного атома), наоборот, более активны, чем соединения жирного ряда (ведут себя как соединения аллильного типа).
-углеродного атома), наоборот, более активны, чем соединения жирного ряда (ведут себя как соединения аллильного типа).
Причина – в промежуточном образовании очень устойчивого сопряженного карбиона, благодаря чему реакции идут всегда по механизму SN1, например,
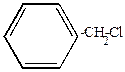
| медленно
 Cl- +
диссоциация
на ионы Cl- +
диссоциация
на ионы
| 
| быстро
HOH
| 
| +H+ |
| Хлористый бензил А |
r=k[A]
Кроме реакций нуклеофильного замещения, ароматические галогенопроизводные дают реакцию образования металлорганических соединений.
Значение: галогенопроизводные ароматического ряда используются в качестве растворителей и ядохимикатов.






