Химические свойства
Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
Правила ориентации в бензольном ядре
Как и собственно бензол, гомологи бензола также вступают в реакцию электрофильного замещения. Однако, существенной особенностью этих реакций является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Иными словами, каждый заместитель бензольного ядра обладает определенным направляющим (или ориентирующим) действием. Закономерности, определяющие направление реакций замещения в бензольном ядре, называются правилами ориентации.
Все заместители по характеру своего ориентирующего действия делятся на две группы.
Заместители первого рода (или орто-пара-ориентанты) – это атомы или группы атомов, способные отдавать электроны (электронодонорные). К ним относятся углеводородные радикалы, группы –OH и –NH2, а также галогены. Перечисленные заместители (кроме галогенов) увеличивают активность бензольного ядра. Заместители первого рода ориентируют новый заместитель преимущественно в орто- и пара-положение.
2  + 2H2SO4 ®
+ 2H2SO4 ®  (о-толуолсульфок-та) +
(о-толуолсульфок-та) +  (п-толуолсульфок-та) + 2H2O
(п-толуолсульфок-та) + 2H2O
2  + 2Cl2 –AlCl3®
+ 2Cl2 –AlCl3®  (о-хлортолуол) +
(о-хлортолуол) +  (п-хлортолуол) + 2HCl
(п-хлортолуол) + 2HCl
Рассматривая последнюю реакцию, необходимо отметить, что в отсутствии катализаторов на свету или при нагревании (т.е. в тех же условиях, что и у алканов) галоген можно ввести в боковую цепь. Механизм реакции замещения в этом случае радикальный.
 + Cl2 –hν®
+ Cl2 –hν®  (хлористый бензил) + HCl
(хлористый бензил) + HCl
Заместители второго рода (мета-ориентанты) – это способные оттягивать, принимать электроны от бензольного ядра электроноакцепторные группировки. К ним относятся: –NO2, –COOH, –CHO, –COR, –SO3H.
Заместители второго рода уменьшают активность бензольного ядра, они направляют новый заместитель в мета-положение.
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (м-динитробензол) + H2O
(м-динитробензол) + H2O
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (м-нитробензойная кислота) + H2O
(м-нитробензойная кислота) + H2O
Электрофильное замещение в бензоле
Несмотря на то, что бензол по составу является ненасыщенным соединением, для него не характерны реакции присоединения. Типичными реакциями бензольного кольца являются реакции замещения атомов водорода – точнее говоря, реакции электрофильного замещения.
Рассмотрим механизм реакции электрофильного замещения в ряду бензола на примере реакции хлорирования.
Первичной стадией является генерирование электрофильной частицы. Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле галогена под действием катализатора и представляет собой хлорид-катион.

| + AlCl3 → Cl+ + AlCl4- |
Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого - комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.

| + Cl+ → | 
| Cl+ |
| π-комплекс |
Иными словами, π-комплекс – это простое электростатическое взаимодействие электрофила и π- электронного облака ароматического ядра.
Далее происходит переход π-комплекса в σ-комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона π-электронного секстета и образует σ-связь с одним из атомов углерода бензольного кольца.

| Cl+ ® |  σ- комплекс σ- комплекс
|
σ-Комплекс – это катион, лишенный ароматической структуры, с четырьмя π-электронами, делокализованными (иначе говоря, распределенными) в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2- до sp3-, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.
На заключительной стадии реакции происходит отщепление протона от σ-комплекса и ароматическая система восстанавливается, поскольку недостающая до ароматического секстета пара электронов возвращается в бензольное ядро.
 ®
®  + H+
+ H+
Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
H+ + AlCl4- ® HCl + AlCl3
Рассмотрим примеры наиболее характерных реакций этого типа.
1. Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 –AlCl3®
+ Cl2 –AlCl3®  (хлорбензол) + H2O
(хлорбензол) + H2O
2.Нитрование.
Нитрование бензола гладко протекает при использовании в качестве нитрующего агента смеси концентрированной азотной и серной кислот.
Механизм реакции электрофильный.
HOSO2OH +HONO2
+ 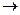 H3O+ + NO2+ +2 OSO2OH -
H3O+ + NO2+ +2 OSO2OH -
HOSO2OH Нитроний-катион –
нитрующий агент
| NO2+ + | 
| 600C
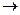
| 
| +H+ |
H+ + OSO2OH- 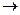 H2SO4
H2SO4
H3O+ + OSO2OH- 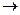 H2O + H2SO4
H2O + H2SO4
При использовании избытка нитрующей смеси и повышении температуры можно ввести вторую и третью нитрогруппы.

| 1100C
+ HONO2 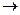 H2O +
(H2SO4) H2O +
(H2SO4)
| 
|
HONO2
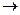 H2O +
3000C H2O +
3000C
| 
|
| М-динитробензол |






