Отдельные представители
Бензойная кислота С6H5COOH – входит в состав различных ароматических веществ, встречающихся в природе.
Перуанский бальзам (бензиловый эфир бензойной кислоты), клюква.
Промышленное получение
Окисление толуола избытком кислорода

| 1500C
(нафтенат, кобальт)
+ 1,5 O2  Р=4 ат
Р=4 ат
| 
| +H2O |
Применение
1) консервант, используется в медицине в виде Na-соли;
2) эфиры – в парфюмерии.
Производные бензойной кислоты
Замещенные в ядре бензойные кислоты.
Получаются двумя путями:
1) Мета-изомеры – путем сульфирования, нитрования и галоидирования бензойной кислоты и последующих превращений полученных соединений.
Например,
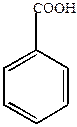
|
HNO3
 H2SO4
H2SO4
| 
|
H2

| 
|

|
1) диазотиро-вание

| 
| ||||
2) реакции с выделением азота

| 
|
2) о- и п-изомеры получают из толуола, который сульфируют, нитруют и галоидируют, а затем окисляют. Потом имеющиеся группы могут подвергаться дальнейшим превращениям.
Например,

| +HONO2 |
 
| 
|
3О

| 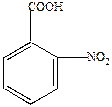
|
3H2

| 
|

| 
|
1) 3O
 2)3H2
2)3H2
| 
| о-аминобензойная кислота | |||
| п-аминобензой-ная кислота |
Антраниловая (о-аминобензойная кислота) используется в синтезе красителей, например, индиго.
П-аминобензойная кислота относится к группе витаминов, применяется в синтезе обезболивающих препаратов:

анастезин – местное обезболивающее средство – ее эфир с этиловым спиртом, новокаин – более сильно обезболивающее средство – ее эфир с  -этиламиноэтиловым спиртом.
-этиламиноэтиловым спиртом.

| + | 
|

| 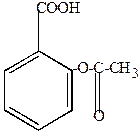
| + CH3COOH |
| ацилирование по фенольной группе | ацетилсалициловая кислота ацетил (спираевая), аспирин |
Аспирин – ацетил + спираевая кислота (старое название салициловой кислоты)

|
.. POCl3
+ HOC6H5 
| 
| + H2O |
| образуется сложный эфир по карбокси-группе | “салол” фениловый эфир салициловой кислоты (в фармацевтике – дезинфицирует кишечник) |
Наличие фенилгидроксила в салициловой кислоте делает ядро более способным вступать в реакции электрофильного замещения, например, с бромом.

|
+2 Br2  [H2O]
[H2O]
| 
|
| 3,5-дибромсалициловая кислота |
Используется как консервант фруктов и для получения лекарственных веществ.
Галловая кислота

3,4,5-триоксибензойная кислота
Очень распространена в природе. В виде глюкозидов, входит в состав различных дубильных веществ (таннин). Легко отщепляет СО2 (при нагревании), образуя трехатомный фенол – пирогаллол.

|
t0
 CO2 + CO2 +
| 
|
| галловая кислота | пирогаллол |
Применяется для получения пирогаллола, при синтезе красителей в аналитике.
Двухосновные ароматические кислоты
Наибольшее применение имеют: фталевая (о-бензолдикарбоновая кислота), терефталевая (п-бензолдикарбоновая кислота) и изофталевая (м-бензолдикарбоновая кислота).
Фталевая кислота
Промышленное получение.
1) Окисление нафталина – наиболее важнейший промышленный метод

| V2O5
+ 4,5 O2  3500
(парофазное
окисление)
3500
(парофазное
окисление)
| 
| +2 CO2 + H2O |
2) окисление о-ксилола

|
+3 O2  4500
(парофазное
окисление)
4500
(парофазное
окисление)
| 
| + 2H2O |
Фталевая кислота способна образовывать циклические производные.
Фталевый ангидрид
Образуется при нагревании фталевой кислоты

|
t
 H2O + H2O +
| 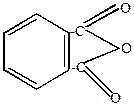
|
Находит широкое применение в промышленности и тонком органическом синтезе.
1) Применяется для получения сложных эфиров при взаимодействии со спиртами.

|
+ CH3OH  ..
..
| 
| ..
CH3OH
 H2O +
(H+) H2O +
(H+)
| 
|
| метилфталат | диметилфталат |
Эфиры с более тяжелыми алкильными группами применяются в качестве пластификаторов полимерных композиций (особенно для поливинилхлорида) и мягчителей – дибутилфталат.
2) Получение синтетических полиэфирных смол путем поликонденсации фталевого ангидрида с многоатомными спиртами.
Глифталевые соли

| + | 
| + | 
|

| |

| 
| + | 
| и т.д.

| ||

| 
|

 плавкая смола линейного строения
плавкая смола линейного строения
|
Если фталевый ангидрид взят в избытке, то он прореагирует с оставшимися группами ОН, образуя поперечные связи между полимерными цепями, и получится неплавкая термореактивная смола сетчатой структуры. Глифталевые смолы служат основой лаков, эмалей и пленок.
Фталимид
Образуется при пропускании сухого аммиака через нагретый фталевый ангидрид.

|
t0
+ NH3  H2O +
сухой H2O +
сухой
| 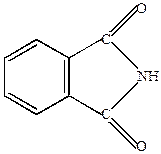
|
| имид фталевой кислоты |
Синтезы на основе фталимида
Атом водорода в имидной группе очень подвижен и может замещаться и даже отщепляться в виде протона, например,
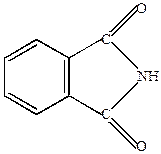
|
+ KOH  H2O +
спиртовый раствор H2O +
спиртовый раствор
| 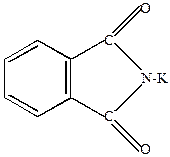
|
| фталимид калий |
который широко используется в синтезах.
Например, реакция Габриэля (применяется для синтеза аминов)
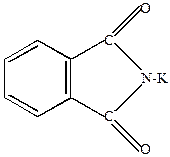
|
+Br-CH2-CH3  KBr +
бромистый этил KBr +
бромистый этил
| 
|
2HOH

|
| N-этилфталимид | |||

| 
| + H2N-CH2-CH3 этиламин | |
| фталевая кислота |
Терефталевая кислота
В промышленности получают окислением п-ксилола

| Mn2+ или Co2+
+3O2  P=40 атм
жидкая фаза
175-2900
P=40 атм
жидкая фаза
175-2900
| 
| +2H2O |
| п-диметилбензол |
Терефталевая кислота получила важное применение с 1950 года для производства полиэфирных смол линейного строения. Полиэтилентерефталат используется для изготовления волокна “лавсан”. Метод прямого взаимодействия этилегликоля с терефталевой кислотой не требует очень чистой терефталевой кислоты. Наиболее распространенным методом получения лавсана была переэтерификация диметилтерефталата этиленгликолем с последующей поликонденсацией.

| + 2 | 
|
 2 CH3OH + 2 CH3OH +
| |
| + | 
| |||
ди-  -оксиэтилтерефталат -оксиэтилтерефталат
|
Затем поликонденсация с отщеплением гликоля
 - (n-1) HO-CH2-CH2-OH
- (n-1) HO-CH2-CH2-OH
| 
|
| полиэтиленгликольтерефталат |
В резиновой промышленности и технологии пластмасс применяют N,N/-диметил-N,N/-динитрозотерефталамид для получения пористых резин и пенопластов.






