Способы получения
Основаны, главным образом, на использовании реакций вюрца-Фиттига и Фриделя-Крафтса. Эти реакции имеют здесь определенное ограничение:
1) Реакция Вюрца идет только с иодарилами.
2 C6H5I + 2 Na  C6H5-C6H5 + 2 NaI
C6H5-C6H5 + 2 NaI
2) Для получения многоядерных углеводородов с помощью реакции Фриделя-Крафтса необходимо использовать полигалогенопроизводные углеводородов.

| AlCl3
+ CHCl3  (C6H5)3CH
-3 HCl (C6H5)3CH
-3 HCl
| |
| хлороформ | трифенилметан |
Физические свойства
Бесцветные вязкие жидкости или кристаллические термостойкие вещества, нерастворимые в воде.
Химические свойства
Проявляют типичные свойства ароматических углеводородов.
Особенности:
1) Реакции электрофильного замещения в ядре идут труднее, чем у одноядерных (при более жестких условиях). Заместители становятся в основном в положение пар- или орто- (если пара-положение заняты).
2) Реакции связующего звена.
Атомы водорода, расположенные в 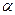 -положении к нескольким ядрам, обладают большей подвижностью и очень легко подвергаются замещению по различным механизмам.
-положении к нескольким ядрам, обладают большей подвижностью и очень легко подвергаются замещению по различным механизмам.
С6H5-СH2-C6H5 + 2 Cl2  C6H5-CCl2-C6H5 + 2 HCl
C6H5-CCl2-C6H5 + 2 HCl
дифенилметан дихлордифенилметан
С6H5-СH2-C6H5 + O2 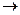
| 
| + H2O |
| дифенилкетон (ацетофенон) |
Наиболее важные группы многоядерных соединений. Группа дифенила
Дифенил может быть получен пиролизом бензола.

| + | 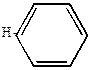
| 7000
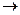 -H2
-H2
| 
| AlCl3
+ 3 Cl2 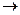
|

|
Благодаря такой высокой термостойкости используется в качестве высокотемпературного теплоносителя в реакторах (Тпл=700С, Ткип=2540С). Производные дифенила с заместителями в орто-положениях, могут иметь оптическую изомерию. Известно, что оптическая изомерия наблюдается у соединений, имеющих асимметричный атом углерода. В дифениле два плоских бензольных кольца соединены простой связью и могут свободно вращаться вокруг этой простой связи,

не имея закрепленного положения в пространстве.
Если в орто-положениях к простой связи имеется несколько заместителей, занимающих значительный объем в пространстве, то они делают свободное вращение невозможным, и кольца приобретают закрепленное положение друг относительно друга. Если сумма радиусов двух о-заместителей превышает 3,0 А0, то расположение ядер в одной плоскости становится невозможным: они поворачиваются друг к другу, под определенным углом, чаще всего под углом 900С. такие молекулы не имеют центра симметрии, и поэтому, хотя у них нет асимметрических атомов, у них наблюдается явление оптической изомерии.
Так, 2,2/-динитродифенил-6,6/-дикарбоновая кислота имеет два изомера:

| 
|
Эти две формы отличаются друг от друга как предмет от зеркального изображения – они являются оптическими антиподами.
Такое явление – наличие пространственных оптических изомеров вследствие торможения свободного вращения – получило название поворотной оптической изомерии.
Группа трифеиилметана
Соединения ряда трифенилметана отличаются особенно высокой реакционной способностью связующего метинового звена. Водород метиновой группы может свободно замещаться реагентами различных типов:
а) свободно-радикальное замещение
h 
(C6H5)3CH + Cl2 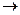 HCl + (C6H5)3CCl
HCl + (C6H5)3CCl
трифенилхлорметан
б) электрофильное замещение
(C6H5)3CH + Na+N-H2 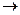 NH3 + (C6H5)3CNa
NH3 + (C6H5)3CNa
трифенилметилнатрий
в) окисление
(C6H5)3CH + O 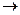 (C6H5)3C-OH
(C6H5)3C-OH
трифенилкарбинол
г) соединения типа трифенилкарбинола под действием концентрированной Н2SO4 растворяются в ней с появлением окрашивания (являются галохромами).
Исследование причин появления окраски показало, что это обуславливается появлением свободных ионов (С6Н6)3С+.
Следовательно, при действии концентрированной серной кислоты трифенилкарбинол ведет себя как основание, образующее ионную соль.
(C6H5)3COH + HOSO2OH  H2O + [(C6H5)3C]+SO4-H
H2O + [(C6H5)3C]+SO4-H
конц. H2O
При разбавлении водой равновесие сдвигается влево (окраска исчезает).
Сравнение всех перечисленных реакций трифенилметана и его производных показывает, что во всех случаях очень легко происходит расщепление молекул исходных веществ с образованием трифенилметильного радикала или ионов (+ или -), что свидетельствует о большой устойчивости этих частиц. Причина их высокой устойчивости кроется в способности к делокализации зарядов или облака неспаренных электронов между тремя бензольными ядрами.

| 
| 
|
Обширная делокализация электронной плотности происходит благодаря тому, что центральный атом углерода во всех этих частицах находится в состоянии sp2-гибридизации, и его три связи расположены в одной плоскости под углом 1200, т.е. в плоскости ядра.






