Самоионизация воды
Вода – очень слабый амфотерный электролит.
Уравнение cамоионизации воды с учетом гидратации иона Н+.

 Н2О + Н2О Н3О+ + ОН-.
Н2О + Н2О Н3О+ + ОН-.
Без учета гидратации ионов Н+ уравнение диссоциации воды:

 Н2О Н+ + ОН-.
Н2О Н+ + ОН-.
Константа диссоциации воды при 250 С составляет:

Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
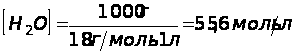
Тогда:

 (при 295 К)
(при 295 К)
Произведение концентрации ионов водорода и гидроксидных ионов называется ионным произведением воды (Kw или KH2O)
КН2О = К ·[ Н2О ]=[Н+] · [ОН-] =10-14
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
При повышении температуры
Т, К 273 298 (250С) 333 373(1000С)
 Кводы-10-14 0,11 1,0 9,55 55
Кводы-10-14 0,11 1,0 9,55 55
КН20 увеличивается
Водородный и гидроксильный показатели.
Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода или гидроксид-ионов.
Как видно из уравнения диссоциации воды концентрация ионов водорода Н+и гидроксид ионов - ОН- в воде одинакова.Т.е. среда нейтральная
При 25 0С [Н+] = [ОН-] = =√10-14=10-7моль/л
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
1.Нейтральная среда – это среда в которой концентрация ионов водорода равна концентрации гидроксид-ионов.
Как видно из уравнения диссоциации воды концентрация ионов водорода Н+и гидроксид ионов - ОН- в воде одинакова.Т.е. среда нейтральная
При 25 0С [Н+] = [ОН-] = =√10-14=10-7моль/л
2.Если концентрация ионов водорода в каком-либо растворе больше, чем в чистой воде ([Н+] >10- 7), то такие растворы называют кислыми.
В этих растворах [Н+]>[ОН-].
3.Если концентрация ионов водорода [Н+] < [ОН-] т.е <10-7,[Н+] < 10 -7, растворы называют щелочными ,
Для того, чтобы удобнее характеризовать концентрацию ионов Н+ и ОН- в растворе, точнее, их активность, Бренстед ввел понятия о водородном и гидроксильном показателях.
Водородный показатель, обозначаемый рН, представляет собой отрицательный десятичный логарифм концентрации Н+-ионов:
PH = -lg[H+].
Соответственно гидроксильный показатель рОН=—lg [OH-].
Следовательно, рН+рОН=14
Примеры расчётов:
если [Н+] = 10-3 моль /л, то рН=3, среда раствора кислая.
если [Н+] = 10-12 моль/л, то рН=12 – среда раствора щелочная.
| КИСЛАЯ | НЕЙТРАЛЬНАЯ | ЩЕЛОЧНАЯ | |
| Концентрация ионов | [Н+] >·= 10-7 | [Н+] ·= 10-7 | [Н+]< 10-7 |
| рН | pН<7 | рH=7 | рH>7 |
- чем рН меньше 7, тем больше кислотность растворов.
- чем рН больше 7, тем больше щелочность раствора
Величины рН количественно характеризуют кислотность и щелочность растворов:
| рН | 0-3 | 4-6 | 8-10 | 11-14 | |
| Среда раствора | Сильно-кислая | Слабо- кислая | Нейтральная | Слабо-щелочная | Сильно-щелочная |
Итак,
1. нейтральная среда – это среда в которой концентрация ионов водорода равна концентрации гидроксильных ионов.
2. кислая среда – это среда, в которой концентрация ионов водорода больше концентрации гидроксильных ионов.
3. щелочная среда – это среда, в которой концентрация ионов водорода меньше концентрации гидроксильных ионов.
Определенное значение рН раствора — важнейшее условие проведения аналитических реакций.
Величину рН можно определить экспериментально или рассчитать.
Существуют разные методы измерения рН водных растворов.
При экспериментальном определении точное значение рН измеряют на специальных приборах — рН-метрах с помощью стеклянного электрода.
Менее точным, но более быстрым и доступным способом является определение рН с помощью различных кислотно-основных индикаторов. Кислотно-основные индикаторы — это вещества, окраска которых в растворе зависит от рН раствора. Индикаторы могут быть использованы как в виде растворов, так и в виде пропитанной ими индикаторной бумаги.






