Процесс өтіп жатқан кезде алып келінген (немесе алып кетілген) жылудың мөлшерін термодинамиканың бірінші заңының теңдеуін қолданып анықтауға болады.
q=Cn(Т2-Т1)=Сv  , (1.4.22)
, (1.4.22)
мұндағы Сn – политроп процесіндегі идеал газдың жылусыйымдылығын көрсетеді.
(1.4.2.1) теңдеуі политроп процесіндегі жылусыйымдылығының мөлшерін анықтайды
Егер (1.4.21) және (1.4.19) теңдеулеріне n-нің мәнін қойсақ онда жылусыйымдылық мөлшерін анықтауға болады (изохоралық, изобарлық, изотермалық, адиабатты процестер үшін).
Политроптық процесс барлық негізгі термодинамикалық процестердің бірлігін анықтайды:
Изохоралық процесс үшін n=  , Cn= Cp, V=idem.
, Cn= Cp, V=idem.
Изобарлық процесс үшін n=0, Cn= KCv= Cp, P=idem.
Изотермалық процесс үшін n=1, Cn=  , VP=idem.
, VP=idem.
Адиабаттық процесс үшін n=k, Cn= 0= Cq PVk=idem.
1.13 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген

1.13-сурет
T,S - жылу диаграммасы. T, S-диаграммасындағы идеал газдардың негізгі термодинамикалық процестері және негізгі күй параметрлері арқылы энтропияның өзгеруі.
Идеал газдың негізгі термодинамикалық процестері және энтропияның S негізгі параметрлер арқылы өзгеруі Т,S - диаграммасында көрсетілген (1.14 - сурет) Егер энтропия S абцисса өсіне салынса, ал абсолюттік температура Т ордината өсіне салынса, онда T, S – диаграммасын аламыз.

1.14-сурет
T,S диаграммасы мыналарды анықтайды:
6. Графиктік тәсілмен процестегі Т= 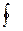 (S) сызығы бойыншажылу мөлшелерін бағалауға болады, яғни dS=
(S) сызығы бойыншажылу мөлшелерін бағалауға болады, яғни dS=  ; dq=ТdS; q1-2=
; dq=ТdS; q1-2=  ТdS.
ТdS.
7. Термодинамикалық процестердің немесе жылу ағындарының бағытын анықтау.
8. Жылусыйымдылығын анықтау С=  =
=  ;
;
9. Жұысты анықтау lц=q1-q2
Егер процесс жылуды беріп жұмыс жасаса онда dq>0; сонымен dS>0, себебі Т>0, яғни барлық уақытта жұмыстық дененін энтропиясы өседі. Бұл кезде Т,S диаграммадағы процесс сызығы солдан оңға қарай бағыттыады, бұл жағдайда ұлғаю процесі жүреді.
Егер процесте жылуды беру болса онда, dq< 0;және dS< 0, демек жұмыстық дененің энтропиясы азаяды және процесс сызығы оңнан солға қарай бағыттылады (сығылу процесі жүреді). Энтропияны күй функциясы ретінде қарауға болады, оның кез келген прпоцесте өзгеруін есептеуге болады, егер оның екі күй параметрі белгілі болса, мысалы V және Т, Р және Т, Р жәнеV.
Изохоралық процестегі энтропиының өзгерісі мына формула мен анықталады.
(S2-S1)=ΔSv =Cvln  =Сvln
=Сvln 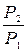 , (1.4.23)
, (1.4.23)
Яғни изохорада Сv=idem,болғанда энтропияның температураға тәуелділігі логорифмдік сипатта болады (1.4.14)
Энтропияның изобарлық процесте Ср=idem болғанда өзгеруі мынаған тең
(S2=S1)=ΔSp=Cpln( ) =Срln(
) =Срln( ), (1.4.24)
), (1.4.24)
Яғни изобарлық процестегі энтропияның температураға тәуелділігі логорифмдік сиппатта болады, бірақ Ср>Сv болғандықтан, Т,S диаграммасындағы изобара, изохораға қарағанда көлбеу жатады.
Изотермалық процестегі энтропияның өзгеруін былай жазуға болады
(S2-S1)т=ΔSт=Rln 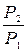 =Rln
=Rln 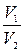 , (1.4.25)
, (1.4.25)
Изотермалық процесте dT=0, жұмыстық дененің энтропиясы өзгермейді (dT=0, T=idem), сонымен Т,S диаграммасында, изотермалық процесс ордината өсіне ║көрсетіледі. (1.15- сурет)
Адиабатты процсете δq=0 тең болғандықтан, жұмысшы дененің энтропиясы өзгермейді (dS=0және S=idem). Сондықтан T,S - диаграммасында адиабаттық процесс тік келеді (1.15 – сурет)
Политроптық процесте энтропияның өзгеруін мына формуламен анықтайды.
(S2-S1)n = ΔSn = Cn ln T2/T1 = [Cv(n-K) / (n-1)]lnT2/T1. (1.4.26)
1.15 – суретте Т, S диаграммада идеал газдың негізгі термодинамикалық процестердің өз-ара орналасуы келтірілген. Барлық процестер бір нүктеден басталады (ортасы 1-ші нүкте).

1.15 – сурет
Әдебиеттер: 2[46-53, 28-30]; 4 [32-35, 25-28]; 5 [33-35, 57-67];
Бақылау сұрақтары:
1. Барлық берілген жылу жұмыс жасауға кететінді қандай процесс дейді?
2. Барлық берілген жылу ішкі энергияның өзгеруіне кететінді қандай процесс дейді?
3. Жұмыс тек ішкі энергияның азаюы арқылы жасалытынды қандай процесс дейді?
4. Термодинамиканың бірінші заңын жеке әр термодинамикалық процестерге жазыңыз?
5. Изобарлық процесте жыл мөлшері ішкі энергияның өзгеруіне тең болатынын дәлелде.
6. Әр процестер үшін P, V және T, V параметрлерінің арасындағы қатынысы көрсететін формулаларда жазыңыз.
7. Негізгі прцестердің формуларын жазыңыз.
8. Политроплық процесс дегеніміз не?
9. Газдың ұлғаюында және сығылуында P, V – диаграммасында бір нүктеден жүргізілген изотермалық және адиабаттық процестердің орналысуы қандай?
10. Әр түрлі негізгі термодинамикалық процестер үшін политроптық көрсеткіштің мәндері қандай?
11. Политроптық процестің жылусыйымдылығының теңдеуін жазыңыздар және осы теңдеуден әр түрлі негізгі термодинамикалық процестер үшін, олардың жылусыйымдылықтарын алуға болатынын көрсетініз.
12. Изохорлық, изобарлық, адиабаттық, изотермиялық және политроптық процестерде энтропияның өзгеруі қандай теңдеулермен есептеледі?
Дәріс тақырыбы 5






