Егер қоспа массалық үлеспен берілсе, онда оның массалық жылусыйымдылығы келесі жалпы көрініспен анықталады.
 Дж/(кг·К) (1.1.20)
Дж/(кг·К) (1.1.20)
Егер қоспа көлемдік үлеспен берілсе:
 (1.1.21)
(1.1.21)
Қоспаның құрамындағы молярлық жылусыйымдылықтарды біле отырып, қоспаның мольдік жылусыйымдылығын анықтауға болады.
 Дж/(моль·К) (1.1.22)
Дж/(моль·К) (1.1.22)
Қоспаның құрамына кіретін компоненттердің парциалдық қысымын былайша анықтауға болады:
егер массалық құрам белгілі болса;
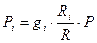 (1.1.23)
(1.1.23)
егер көлемдік құрам белгілі болса,
 (1.1.24)
(1.1.24)
Әдебиеттер: 2[6-13, 20-25]; 4 [3-12, 22-24]; 5 [3-12]; 12қос.[4-12, 21-22],
2[63-66], 8[13-16].
Бақылау сұрақтары:
1.Біздің еліміздің халық шаруашылығында, металлургия, тау-кен, мұнай және газ кәсіпшілігінде жылу энергетикасының қандай маңызы бар?
2.Термодинамикалық жүйе дегеніміз не?
3.Термодинамикалық процесс дегеніміз не?
4.Қандай күйлерді және процестерді тепе-теңділіктер және тепе-теңсіздіктер дейді?
5.Күй теңдеуі дегеніміз не?
6.Қандай процестерді қайтымдылар және қайтымсыздар дейміз?
7.Дененің жылулық күйін қандай параметрлер анықтайды және олар қандай өлшем бірлікпен өлшенеді?
8.Әмбебапбық газ тұрақтысына анықтама бер және қандай өлшем бірлікпен өлшенеді?
9.Негізгіге қандай термодинамикалық параметрлер жатады?
10. Газ қоспаларының берілу тәсілдері.
11. Парциалдық қысым дегеніміз не?
Дәріс тақырыбы 2
Термодинамиканың бірінші заңы
Дәріс конспектіcі
Термодинамиканың бірінші заңы жылу құбылыстары үшін қолданылатын жалпы энергияның сақталу және (айналу) өзгеру заңының дербес жағдайы болады. Термодинамикалық жүйелердегі өтетін жылулық құбылстарға немесе процестер сәйкес, бұл заң бойынша энергия жоғалмайды және жаңадан пайда болмайды, ол физикалық және химиялық процестерде бір түрден екінші түрге айналады.
Бұл заң жылу жұмысқа - жұмыс жылуға айналуын белгілі қалыпқа келтіру (орнату) заңы.
Техникалық термодинамикада энергияның жылу Q және механикалық жұмыс l түрінде өзгеруін қарастырады. Демек термодинамиканың 1- ші заңына сәйкес, жүйеде басқа ешқандай өзгерістер болмағандықтан энергияның сақталу заңы бойынша
dQ=dU+dL=dU+pdV (1.2.1)
немесе Q=ΔU+L=(U2-U1)+  pdV. (1.2.2)
pdV. (1.2.2)
(1.2.1) және (1.2.2) теңдеулерден жұмыстық денелерге берілген энергия жылу түрінде дененің сыртқы жұмысына pdV (dL) және ішкі энергияларды ДU (du) өзгертуге жұмсалады.
Газдардың ішкі энергиясының ДU өзгеруі процестің өзгеруіне өзгешілігіне немесе күйіне байланысты емес, сондықтан ішкі энергия дененің бастапқы және соңғы күйлерімен анықталады.
ДU=U2-U1=f2 (P2,V2, T2)-f1(P1, V1, T1) (1.2.3)
Барлық термодинамикалық процестердегі жұмыстық дененің ішкі энергиясының өзгеруін мынандай жалпы формуламен анықтайды.
dU=Cv dT
немесе
ДU=Cv(Т2-Т1) (1.2.4)
Көлемі шексіз аз өзгерергендегі dv ауданды, 1.2-суретте көрсетеілген жүйедегі дененің күйі тепе-тең өзгерудегі пайда болған элементтарлық жұмысты мына формула мен анықтайды.
dl=pdv (1.2.5)
Сондықтан, толық жұмысты жүйдегі көлемнің соңғы тепе-тең өзгеруі процесінде 1-2 қыйсық сызықпен анықтайды және ол мынаған тең
l=  pdv=1.2.3.4 ауд. (1.2.5’)
pdv=1.2.3.4 ауд. (1.2.5’)
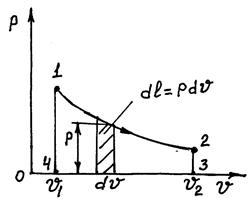
1.2-сурет
Егер V2 >V1 – болғанда газ ұлғаяды, мұнда dV>0 болады, ал жасалған жұмыс шамасы оң болады, онда lұлғ>0, себебі дене жұмысты өзі істейді.
Егер V2 < V1, болғанда газ сығылады, мұнда dV< 0 болады, ал жұмыс мәні теріс болады.
Істелген жұмыстың оң немесе теріс болуының физикалық мағынасы, газ ұлғайғанда сырттан әсер етуші күшке қарсы жұмыс жасалады, ал сығылғанда сырттан әсер етуші күшке қарсы газ жұмыс жасайды.
Жылу және жұмыс - процестің функциясы, олардың элементтарлық шамалары dq және dl мәндері толық дифференциал бола алмайды, ал ішкі энергия күйдің функциясы болады, сондықтан dU-толық дифференциалы болады.
Өткен ғасырда атақты физик Гиббс, кейін Каммерлинг-Оннес, жылу аппаратарына жылулық есептеуде, жұмыстық дененің күйін анықтау үшін жаңа функция ретінде энтальпия деген ұғымды енгізді.
Термодинамикада энтальпия (Н) деген ұғым үлкен орын алады, ол жүйенің ішкі энергияның және қысым мен көлемнің көбейтіндісінің қосындысына тең.
Н=U+PV (1.2.6)
Меншікті энтальпия h әртімен белгіленіп h=  , 1 кг заты бар жүйенің энтальпиясын көрсетеді, ал өлшем бірлігі Дж/кг болады да келесі теңдеумен анықталады
, 1 кг заты бар жүйенің энтальпиясын көрсетеді, ал өлшем бірлігі Дж/кг болады да келесі теңдеумен анықталады
h=u+Pυ (1.2.7)
Энтальпия күйдің функциясы бола турып, энтальпияға U,P,V шамалары да кіреді әрі ол күй параметрі (функция) болып есептеледі.
Сонымен энтальпия кейбір күй функциясы және термодинамикалық функцияны көрсетеді, толық мәнде (ішкі U және сыртқы P,V) жүйелік энергияны және денедегі жылуды сиппатайды.
Термодинамиканың бірінші заңын энтальпия арқылы былай жазуға болады.
dL=dU+pdV=dU+d(pV)-Vdp=d(U+pV)=dH-Vdp (1.2.8)
немесе q1-2=h2-h1-  vdP, (1.2.9)
vdP, (1.2.9)
мұндағы dlтех=-vdP (1.2.10)
Не былай жазуға болады lтех= -  vdp=
vdp=  =vdP, (1.2.11)
=vdP, (1.2.11)
мұндағы lтех – қысымы өзгергендегі дененің меншікті техникалық жұмысы.
1.3-суретте алынған тәуелділік, PV-диаграммада график түрінде көрнекті бейнелеген.

1.3 - сурет
Кинетикалық энергияның ағыны немесе газдардың қысымы өзгергенде техникалық жұмыс lтех пайда болады.
Егер аппараттағы қысым азайса (мысалы турбинада), онда dP<0, олай болса -  VdP>0, демек техникалық жұмыс lтех >0 оң болады.Бұнда жұмыс сыртқы нәрсеге қарсы ағын түрде пайда болады.
VdP>0, демек техникалық жұмыс lтех >0 оң болады.Бұнда жұмыс сыртқы нәрсеге қарсы ағын түрде пайда болады.
Егер керсінше, қысым аппаратта көбейсе (мысалы компрессорда) онда dP>0, демек -  VdP>0, техникалық жұмыс теріс болады. Бұл жағдайда жұмыс сыртқы двигательмен ағынға қарсы әсер етеді.
VdP>0, техникалық жұмыс теріс болады. Бұл жағдайда жұмыс сыртқы двигательмен ағынға қарсы әсер етеді.
1.2.8 теңдеуге кіретін техникалық жұмыс lтех – бұл сұйық не газ ағындарында орналасқан қандайда бір агрегеттардың (мысалы турбиналар, компрессорлар, насостар мен желдеткіштер), пайдалы жұмысы. Егер мұндай (немесе осы сияқты) агрегет болмаса lтехн=0
Әдебиеттер: 2[14-20, 25-27]; 4[17-22]; 5[16-23, 30-32]; 12[15-20, 22-24];
Бақылау сурақтары:
1. Жылу мен жұмыс қай кезде оң және қай кезде теріс деп есептеледі?
2. Дөңгелек прцесс (цикл) дегенеміз не?
3. Термодинамиканың бірінші заңының мәндерін дифференциалды және соңғы түрінде жазыңыз; оған анықтама берініз
4. «Күйдің функциясы» және «процестің функциясы» дегенеміз не?
5. Жылу, жұмыс және ішкі энергия дегеніміз не?
6. Неге термодинамиканың бірінші заңы энергияның сақталу және алмасу заңы деп аталады?
7. Меншікті жылу сыйымдылыққа анықтама бер.
8. Энтальпия дегеніміз не?
9. Дөнгелек процесте ішкі энергияның және энтальпияның өзгеруі неге тең?
Дәріс тақырыбы 3






