Всероссийская олимпиада школьников
Муниципальный этап
Учебный год
Ноября 2012
Класс
Решения задач
Задание 1
Решение представлено в виде таблицы.
| Признак, свойство | Железо | Золото |
| Окраска | Белая или светло-серая | Желтая |
| Действие магнита | Притягивается | Не притягивается |
| Отношение к воде | Ржавеет, покрывается коричневым налетом | Не изменяется |
| Отношение к разбавленным кислотам | Растворяется, реагирует | Не изменяется |
| Отношение к ртути | Плавает на поверхности | Тонет и постепенно растворяется |
Задание 2
Масса соли в исходном растворе: 200 ∙ 0.3 = 60 (г).
Масса соли в оставшемся растворе: 60 − 20 = 40 (г).
Масса оставшегося раствора: 200 − 20 = 180 (г).
Массовая доля соли в оставшемся растворе 40 / 180 = 0.222, или 22.2 %.
Задание 3
Заполненная таблица имеет вид:
| Обозначение | 22Ne | 16O2− | 7Li+ | 27Al3+ |
| Число протонов в ядре | ||||
| Число нейтронов в ядре | ||||
| Число электронов у частицы | ||||
| Заряд частицы | −2 | +1 | +3 |
Задание 4
Изменение окраски растворов связано с присутствием индикатора, который, судя по характеру окраски, может быть фенолфталеином.
4.1. Жидкость A – водный раствор щелочи, например, гидроксида натрия. Жидкость B – водный раствор кислоты, например, серной, и фенолфталеина.
4.2. Малиновая окраска раствора возникает в момент, когда добавляемая в виде раствора щелочь полностью нейтрализует кислоту и окажется в избытке. В щелочной среде фенолфталеин окрашивается в малиновый цвет. При добавлении к раствору кислоты ранее добавленный избыток щелочи будет нейтрализован, и в случае избытка кислоты окраска раствора станет бесцветной. В кислой среде фенолфталеин бесцветен.
Рекомендации по оценке решения
| Задача 1. | |
| Зв выбор признаков (3 признака) | 9 баллов |
| За характеристику железа по выбранным признакам (3 явления) | 9 баллов |
| За характеристику золота по выбранным признакам (3 явления) | 9 баллов |
| Всего | 27 баллов |
| Задача 2. | |
| За расчет массы соли в исходном растворе | 5 баллов |
| За расчет массы соли в оставшемся растворе | 5 баллов |
| За расчет массы оставшегося раствора | 5 баллов |
| За расчет массовой доли соли в оставшемся растворе | 5 баллов |
| Всего | 20 баллов |
| Задача 3. | |
| Заполнение пропуска (9 пропусков) | 27 баллов |
| Всего | 27 баллов |
| Задача 4. | |
| За установление природы компонентов растворов (2 раствора) | 14 баллов |
| За объяснение причины появления и исчезновения окраски (2 явления) | 12 баллов |
| Всего | 26 баллов |
| Общая оценка решения | 100 баллов |
Всероссийская олимпиада школьников
Муниципальный этап
Учебный год
Ноября 2012
Класс
Решения задач
Задание 1
1. Ответы на вопросы.
1.1. Окраска обусловлена простым веществом йодом I2.
1.2. 4 HI + O2 ¾® 2 I2 + 2 H2O.
1.3. Добавление к раствору органического растворителя, например, бензола, толуола, тетрахлорметана. Йод переходит (экстрагируется) в органическую фазу, которая отделяется от водного раствора йодоводородной кислоты в делительной воронке.
Задание 2
Один из возможных способов очистки основан на действии избытка раствора щелочи на водный раствор загрязненного железом хлорида алюминия.
2.1. Стадия 1. Растворяем исходное вещество в воде при комнатной температуре, при необходимости отделяет взвешенные частицы фильтрованием.
Стадия 2. Добавляем к полученному раствору избыток раствора щелочи, например, NaOH. Выпадающий первоначально осадок частично растворяется. В раствор переходит алюминий в виде Na[Al(OH)4] или, точнее, Na[Al(OH)4(H2O)2]. В осадке остается гидроксид железа Fe(OH)3 желто-коричневого цвета, нерастворимый в растворе щелочи.
Стадия 3. Отделяем осадок гидроксида железа фильтрованием.
Стадия 4. Добиваемся осаждения гидроксида алюминия Al(OH)3 (белый осадок) действием недостатка соляной кислоты (в промышленности вместо соляной кислоты используется углекислый газ).
Стадия 5. Отделяем осадок от раствора фильтрованием. В растворе остаются соли натрия.
Стадия 6. Растворяем осадок гидроксида алюминия в соляной кислоте и закристаллизовываем раствор.
2.2. Уравнения реакций.
AlCl3 + 3 NaOH ¾® Al(OH)3↓ + 3 NaCl,
FeCl3 + 3 NaOH ¾® Fe(OH)3↓ + 3 NaCl,
Al(OH)3 + NaOH ¾® Na[Al(OH)4],
Na[Al(OH)4] + HCl ¾® Al(OH)3↓ + NaCl + H2O,
Al(OH)3 + 3 HCl ¾® AlCl3 + 3 H2O.
Задание 3
Превращение сульфида в хлорид можно отразить стехиометрической схемой (x − валентность элемента):
M2S x ¾® 2MCl x.
Пусть A − атомная масса элемента. Тогда массы исходного сульфида и полученного хлорида связаны друг с другом по условию задачи выражением:

,
откуда после тождественных преобразований

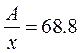
и далее,
Задавая целочисленные значения валентности x, проверим физический смысл вариантов.
| x | A | Вариант | Комментарий |
| 68.8 | Zn или Ga | Не являются одновалентными | |
| 137.6 | Ba | Двухвалентен, образует сульфид BaS и хлорид BaCl2 | |
| 206.4 | Tl или Pb | Не образуют сульфидов в состоянии окисления +3 | |
| 275.2 | Нет |
Таким образом, в задаче речь идет о сульфиде и хлориде бария.
Задание 4
При окислении 1 моль серы (32 г) получается 1 моль SO2 (64 г) и далее 1 моль SO3. Это означает, что 8 г серы при окислении сначала превратятся в 16 г SO2 и далее перейдут в SO3.
При окислении 16 г SO2 до SO3 выделится вдвое большее количество теплоты, чем указанное в условии значение для 8 г SO2, а именно 24 кДж. Поскольку тепловые эффекты последовательных процессов суммируются, то при окислении 8 г серы до SO3 выделится 74 + 24 = 98 кДж теплоты.
Рекомендации по оценке решения
| Задача 1 | |
| За указание на йод | 6 баллов |
| За уравнение реакции окисления HI | 6 баллов |
| За способ отделения йода | 10 баллов |
| Всего | 22 балла |
| Задача 2 | |
| За методику очистки | 18 баллов |
| За уравнения реакций | 12 баллов |
| Всего | 30 баллов |
| Задача 3 | |
| За вычисление отношения A / x | 16 баллов |
| За выбор варианта BaS и BaCl2 | 8 баллов |
| Всего | 24 балла |
| Задача 4 | |
| За расчет массы SO2 | 8 баллов |
| За расчет теплоты окисления рассчитанного количества SO2 | 8 баллов |
| За расчет общего теплового эффекта | 8 баллов |
| Всего | 24 балла |
| Максимальная возможная оценка | 100 баллов |






