Кафедра Общей и технической физики
ФИЗИКА
Реальные газы
Методические указания к выполнению лабораторной работы
с использованием компьютерных технологий для студентов
специальности 130400
САНКТ-ПЕТЕРБУРГ
УДК 536.7
ФИЗИКА. Реальные газы. Методические указания к выполнению лабораторной работы с использованием компьютерных технологий / Национальный минерально-сырьевой университет ”Горный”. Сост. Н.Н.Смирнова. СПб, 2014. 25с.
Изложены краткие теоретические сведения по теории реальных газов и эффекту Джоуля-Томсона, а также порядок подготовки и выполнения виртуальной лабораторной работы на компьютере. Сформулированы контрольные вопросы, требования к содержанию отчета и рекомендации по его защите.
Задания разработаны в соответствии с программой по дисциплине ”Физика” Федерального государственного образовательного стандарта по специальности 130400 ”Горное дело”.
Методические указания также могут быть использованы для выполнения лабораторной работы с использованием компьютерных технологий студентами других инженерно-технических специальностей.
Табл. 4. Илл. 6. Библиогр.: 6 назв.
Научный редактор доц. Фицак В.В.
| © Национальный минерально-сырьевой университет ”Горный”, 2014 г. |
ВВЕДЕНИЕ
Совершенствование традиционных форм и методов обучения, а также внедрение инноваций в учебный процесс, позволят подготовить специалистов нового типа, наборы компетенции которых, будут соответствовать жизненно важным конкурентным потребностям горного производства.
Современные образовательные технологии включают методику проведения занятий с использованием компьютерных технологий, в частности виртуальный лабораторный практикум.
Использование компьютерной поддержки в различных видах учебных занятий служит одним из способов формирования мотивационной сферы вфизическом образовании высшей школы.
В виртуальной лабораторной работе реальную установку имитирует системный блок компьютера. Пультом управления является клавиатура. Монитор совмещает функцию цифрового индикатора измерительных приборов и экрана для наблюдения за работой установки и изучаемыми процессами.
Элементы виртуальной установки реагируют на действия пользователя, которые регламентируются методическими указаниями.
Использование виртуальных аналогов лабораторных работ позволяют существенно расширить круг задач, решаемых при выполнении реальных экспериментальных работ и реализовать такие физические эксперименты, постановка которых невозможна или затруднительна в учебной лаборатории.
Применение виртуальных работ обеспечивает наглядную визуализацию лабораторных установок и динамики их работы в реальном или компьютерном масштабе времени.
Для исследования процессов происходящих в реальных газах предлагается виртуальная лабораторная работа в основе которой лежит эффект Джоуля-Томпсона.
Программное обеспечение работы позволяет исследовать поведение реального газа, в частности: изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры.
Предлагаемые базовые задания позволяют студентам, выполняя эвристические предписания методологического характера (подробные инструкции), определить коэффициент Джоуля-Томсона для выбранной температуры, постоянные Ван-дер-Ваальса a и b для углекислого газа по двум парам температур, температуру инверсии Тинв и критическую температуру Ткр для углекислого газа.
Выполнение заданий частично-поискового и поискового характера потребует от студента проявить большую самостоятельность, опираясь на имеющиеся теоретические знания, инструктивную и справочную литературу.
Методика проведения измерений, обработки экспериментальных данных, оценки погрешностей прямых и косвенных измерений, а также процедура подготовки студентов к выполнению работ и защиты отчётов производится в таком же порядке, как и при выполнении работ реального физического практикума в соответствии с требованиями кафедры Общей и технической физики.
1. РЕАЛЬНЫЕ ГАЗЫ
1.1. Силы межмолекулярного взаимодействия
Свойства не сильно разреженных газов отличаются от свойств идеальных газов, подчиняющихся уравнению Менделеева-Клапейрона.
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания. Эти силы по-разному зависят от расстояния между молекулами. На расстояниях, сравнимых с линейными размерами атомов (10–10м), преобладают силы отталкивания 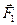 ; на расстояниях порядка 10–9м – силы взаимного притяжения
; на расстояниях порядка 10–9м – силы взаимного притяжения  (рисунок 1). Результирующая сила
(рисунок 1). Результирующая сила
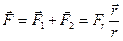 (1)
(1)
 где
где 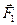 и
и  – силы отталкивания и силы притяжения между молекулами.
– силы отталкивания и силы притяжения между молекулами.
При  ,
, 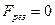 ;
;
при  ,
, 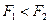 ;
;
при  ,
,  ,
,
где 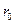 – радиус молекулярного действия,
– радиус молекулярного действия,  соответствует равновесному состоянию между молекулами, на котором они находились бы, если бы не было теплового движения.
соответствует равновесному состоянию между молекулами, на котором они находились бы, если бы не было теплового движения.
1.2. Уравнение Ван-дер-Ваальса
Уравнение Менделеева-Клапейрона достаточно хорошо описывает газ при низких давлениях и высоких температурах, когда он находится в условиях, далеких от условий конденсации и для газов при нормальных условиях.
Для реального газа, особенно при повышенных давлениях и низких температурах, модель идеального газа может оказаться неадекватной. В этом случае необходимо учитывать потенциальную энергию взаимодействия молекул газа между собой и размеры молекул.
Уравнение, описывающее реальный газ, сформулировал в 1873 г. нидерландский физик Ян Дидерик Ван-дер-Ваальс (1837-1923).
Уравнение Ван-дер-Ваальса описывает не только газообразное состояние, но и переход к жидкому и твердому состоянию. Предложенная модель реального газа учитывает факт того, что молекулы газа притягиваются на больших, но отталкиваются на малых расстояниях, близких к размеру молекулы.
Силы притяжения внутри газа скомпенсированы для каждой молекулы, поскольку действуют в среднем одинаково во все стороны. На молекулы, расположенные в тонком слое вблизи границ объема, действует некомпенсированная сила притяжения со стороны других молекул газа, направленная внутрь объема, которая создает дополнительное (внутреннее) давление.
Если уменьшать объем под действием внешнего давления, внутреннее давление растет быстрее внешнего. При равенстве давлений газ превращается в жидкость.
Сила внутреннего давления, действующая на молекулу поверхностного слоя газа должна быть пропорциональна концентрации молекул п в прилегающем внутреннем слое, а суммарная сила внутреннего давления пропорциональна еще и концентрации молекул п в поверхностном слое.
Таким образом, суммарное внутреннее давление пропорционально квадрату концентрации молекул газа
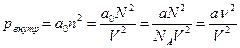 (2)
(2)
где а 0и а – константы, связанные через число Авогадро, а= а 0 NA; п – концентрация молекул; N – количество молекул в V; объеме; ν – число молей.
Суммарное давление p ' внутри газа
 (3)
(3)
где р – давление газа на стенку объема (по третьему закону Ньютона стенка действует на газ тем же давлением).
Поправка на действие сил отталкивания действует на меньших расстояниях и учитывает только парные взаимодействия между молекулами.
Суть ее сводится к учету размеров молекул. Ван-дер-Ваальс предложил в уравнение состояния включить не полный объем сосуда, а только свободный, доступный для движения молекул.
 Каждая молекула уменьшает свободный для движения другой молекулы объем сосуда. При этом радиус исключаемой сферы вдвое превышает радиус молекулы rт (рисунок 2). Объем этой исключаемой сферы, очевидно, в 8 раз превышает объем Vm молекулы.
Каждая молекула уменьшает свободный для движения другой молекулы объем сосуда. При этом радиус исключаемой сферы вдвое превышает радиус молекулы rт (рисунок 2). Объем этой исключаемой сферы, очевидно, в 8 раз превышает объем Vm молекулы.
Это означает, что на каждую из двух рассматриваемых молекул (и на все остальные молекулы) приходится четырехкратный исключаемый объем молекулы 4Vm. Таким образом, на N находящихся в сосуде молекул необходимо исключить объем 4 N Vm.
Свободный объем будет равным
 (4)
(4)
где b= 4 NA Vm.
Подставив суммарное давление газа p ' и свободный объем V 'в уравнение состояния идеального газа, получим уравнение Ван-дер-Ваальса
 (5)
(5)
где а и b – постоянные Ван-дер-Ваальса.
b – поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами и равная учетверенному объему молекул, содержащихся в одном моле газа.
 (6)
(6)
Величина поправки а
 ,(7)
,(7)
Теоретические оценки постоянных Ван-дер-Ваальса носят приближенный характер, более точно для каждого газа они определяются экспериментально.
Экспериментальные значения постоянных Ван-дер-Ваальса для некоторых газов приведены в таблице 4 Приложения.
Термодинамические процессы, приводящие к изменению агрегатного состояния вещества,называются фазовыми переходами.
Выделяют агрегатные состояния: твердое, жидкое, газообразное, др. Изменение агрегатного состояния обычно сопровождается скачкообразным изменением энтропии, плотности и других основных физических свойств вещества.
Уравнение Ван-дер-Ваальсаможно применять для качественных оценок изменений агрегатного состояния вещества.
Уравнение реального газа можно представить в виде зависимости давления газа от его объёма
 (8)
(8)
Из уравнения видно, что при V→∞ доминирует левый член зависимости, и давление, как и для идеального газа, убывает по гиперболическому закону
 (9)
(9)
При V→ 0 доминирует правый член зависимости (внутреннее давление), и давление растет пропорционально V -2
 (10)
(10)
 При невысокой температуре имеют место два экстремума. При этом на изотермах имеется участок, где давление растет с увеличением объема, что не имеет физического смысла.
При невысокой температуре имеют место два экстремума. При этом на изотермах имеется участок, где давление растет с увеличением объема, что не имеет физического смысла.
Экспериментальные изотермы состояния газа отличаются тем, что участок теоретической зависимости, где давление растет сувеличением объема, представляет собой горизонтальный участок, соответствующий сжижению газа, которое при заданной температуре происходит при постоянном давлении.
При повышении температуры этот участок уменьшается и превращается в точку. Эта точка называется критической. Значения давления, объема и температуры в этой точке называют критическими параметрами.
В критической точке кривая имеет точку перегиба, так что обращаются в ноль как первая, так и вторая производные. Из этих условий определяются критические параметры
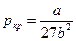 ,
,  ,
,  .(11)
.(11)
Критические параметры для некоторых газов приведены в таблице 4 Приложения.
При температуре выше критической вещество может существовать только в газообразном состоянии. При температуре ниже критической вещество может быть превращено в жидкость.
У гелия, водорода, кислорода и азота критические температуры низкие, и при нормальных условиях они являются газами.
У воды и ртути критические температуры высокие, поэтому при нормальных условиях эти вещества существуют в жидком и в газообразном состоянии.
1.3. Внутренняяэнергия реального газа
Внутренняяэнергия реального газа, в отличие от идеального, дополнительно включает потенциальную энергию межмолекулярного взаимодействия. При этом соотношение между потенциальной энергией взаимодействия двух соседних молекул U M и кинетической энергией теплового движения молекулы, равной по порядку величины kТ, определяет состояние вещества.
Если U M«kT,то взаимодействием можно пренебречь – вещество находится в газообразном состоянии. Если U M ›› kT, то вещество твердое. Если U M ≈ kT, то вещество – в жидком состоянии.
Силы взаимодействия реального газа имеют электрическое или электромагнитное происхождения. Они определяются внутренним давлением р внутр =  . В свою очередь, дополнительную внутреннюю энергию U' реального газа можно связать с работой сил внутреннего давления
. В свою очередь, дополнительную внутреннюю энергию U' реального газа можно связать с работой сил внутреннего давления
dU' = dA = р внутр dV =  dV. (12)
dV. (12)
После интегрирования
U' =  (13)
(13)
Для полной внутренней энергии ν молей реального газа, имеем
U = vCVT + U' = vCVT –  . (14)
. (14)
Из выражения(13) следует, что внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине при изотермическом процессе в газе Ван-дер-Ваальса изменяется его внутренняя энергия. При этом подведенная к газу теплота не равна совершенной им работе.
1.4. Эффект Джоуля – Томсона
В случае медленно протекающего адиабатического расширения реального газа при изменении давления от р 1 к р 2 происходит изменение температуры. Это явление получило название эффекта Джоуля – Томсона, а сам процесс – процессом Джоуля – Томсона. Эффект Джоуля – Томсонашироко используется, например, при сжижении газов.
 На рисунке 4 изображена схема неравновесного расширения газа в адиабатических условиях: на рис. 4, а – начальное состояние системы, рис. 4, б – конечное. В середине цилиндра, помещенного в адиабатическую оболочку, находится перегородка С (узкая щель, пористое тело, дроссель и т. п.), препятствующая быстрому прохождению газа.
На рисунке 4 изображена схема неравновесного расширения газа в адиабатических условиях: на рис. 4, а – начальное состояние системы, рис. 4, б – конечное. В середине цилиндра, помещенного в адиабатическую оболочку, находится перегородка С (узкая щель, пористое тело, дроссель и т. п.), препятствующая быстрому прохождению газа.
Из части А поршнем I через перегородку под давлением р 1, продается газ, в результате чего объем газа изменяется от V 1до нуля, При этом в части В перемещается поршень II и объем газа при постоянном давлении изменяется от нуля до V 2. Так как давления р 1и р 2постоянны в части А газ совершает работу р 1(0 – V 1) = -р 1 V 1, а в части В работу
р 2 (V 2– 0) = p 2 V 2.(15)
Будем считать, что внутренняя энергия системы изменяется на величину U 2– U 1.
Запишем для этого процесса первое начало термодинамики
Q = U 2 - U 1 + p 2 V 2 - р 1 V 1.(16)
Так как процесс адиабатический (Q = 0), то
U 1 + р 1 V 1 = U 2 + p 2 V 2. (17)
Отсюда следует, что в процессе Джоуля – Томсона энтальпиясистемы (U + рV) не изменяется: Н 1 = Н 2 = const.
Здесь Н 1и Н2 – энтальпии, соответствующие начальному и конечном стояниям системы.
Для идеального газа U = c VmТ и  , отсюда энтальпияpaвна
, отсюда энтальпияpaвна
 (18)
(18)
Таким образом, энтальпиядля постоянной массы газа зависит только от температуры.
Для определения изменения температуры одного моля газа преобразуем равенство (17), сделав некоторые упрощения. В левой части давление  большое, поэтому газ здесь будем считать реальным, а в правой части давление
большое, поэтому газ здесь будем считать реальным, а в правой части давление  невелико и, следовательно, газ можно считать идеальным. Следовательно
невелико и, следовательно, газ можно считать идеальным. Следовательно
 (19)
(19)
 (20)
(20)
 (21)
(21)
Из уравнения Ван-дер-Ваальса
 (22)
(22)
Подставим (19-22) в формулу (17)
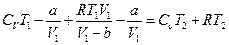 (23)
(23)
Третье слагаемое можно записать в виде
 (24)
(24)
С учетом этого преобразования уравнение (23) примет вид
 (25)
(25)
Отсюда получим формулу для изменения температуры газа при протекании через пористую перегородку
 (26)
(26)
Как видно, знак DT определяется знаком выражения, стоящего в скобках.
Из формулы (26) видно, что для идеального газа (поправки а и b равны 0) DT =0 то есть температура идеального газа при таком расширении не меняется, т.е эффект Джоуля-Томсона отсутствует.
Температура реальных газов в таком процессе может как понижаться Δ T < 0 (положительный эффект Джоуля-Томсона), так и повышаться Δ T > 0 (отрицательный эффект Джоуля-Томсона).
С молекулярно-кинетической точки зрения знак эффекта Джоуля Томсона зависит от того, какая из постоянных Ван-дер-Ваальса (а или b),играет более существенную роль. Другими словами, какой фактор ”неидеальности” газа при данной температуре преобладает: силы притяжения или размер молекул.
Если можно пренебречь поправкой а (а=0), то DT >0, T2>T1, т.е при расширении газ нагревается. Это отрицательный эффект Джоуля-Томсона.
Если можно пренебречь поправкой b (b=0), то DT <0, T2<T1и газ охлаждается. Это положительный эффект Джоуля-Томсона.
Существует температура газа Тi, называемая температурой инверсии, при которой Δ T = 0. Газ, имеющий температуру выше температуры инверсии, нагревается, ниже – охлаждается.
Температура инверсии зависит от давления и свойств газа.
При одной и той же температуре некоторые газы могут нагреваться, а другие охлаждаться. Например, при комнатной температуре и невысоком давлении воздух в процессе Джоуля-Томсона охлаждается, тогда как для кого же эффекта водород следует охладить до 200 К, а гелий – до 40 К.
Для количественной оценки эффекта при малых перепадах температур Δ T и давлений Δ р вводится коэффициент Джоуля - Томсона
 (27)
(27)
Применительно к газу, подчиняющемуся уравнению Ван-дер-Ваальса и при некоторых упрощающих предположениях этот коэффициент равен
 (28)
(28)
где а и b – постоянные Ван-дер-Ваальса, Ср – молярнаятеплоемкость при постоянном давлении, R – молярнаягазовая постоянная, Т – температура продавливаемого газа.
Перепад давлений всегда отрицателен (рисунок 4): Δρ < 0. Следовательно, при положительном эффекте Джоуля-Томсона ΔТ < 0, µ > 0, а при отрицательном эффекте ΔT > 0, µ < 0.
Температуре инверсии соответствует µ = 0, отсюда из (28) имеем
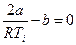 , или
, или  . (29)
. (29)
Из соотношения (29) видно, что чем большую роль играют силы притяжения между молекулами (больше а) и чем меньшую роль играет размер молекул (меньше b), тем выше температура инверсии.
Положительному эффекту Джоуля – Томсона соответствует условие 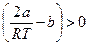 , которое реализуется, например, при b = 0.
, которое реализуется, например, при b = 0.
Это объясняется тем, что при расширении увеличивается потенциальная энергия сил притяжения и, соответственно, уменьшается кинетическая энергия молекул, т. е. температура.
Отрицательному эффекту Джоуля – Томсона соответствует условие 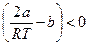 , которое реализуется, например, при а = 0.
, которое реализуется, например, при а = 0.
Физически это соответствует отсутствию межмолекулярных сил притяжения, а постоянная b,связанная с размером молекул, может ассоциироваться с межмолекулярными силами отталкивания, так как такие силы действуют при сближении молекул.
Таким образом, при расширении уменьшается потенциальная энергия сил отталкивания и, соответственно, увеличивается кинетическая энергия теплового движения молекул, т. е. температура.
Так как критическая температура для реальных газов также выражается через поправки а и b (формула 11), то можно получить соотношение между температурой инверсии и критической температурой
 (30)
(30)
2. ЛАБОРАТОРНАЯ РАБОТА
ИССЛЕДОВАНИЕ ЭФФЕКТА ДЖОУЛЯ -ТОМСОНА ПРИ АДИАБАТИЧЕСКОМ ИСТЕЧЕНИИ ГАЗА
Цель работы: определить изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; вычислить коэффициенты Ван-дер-Ваальса "a" и "b" по результатам эксперимента.
Теоретическое содержание работы представлено в первом разделе методических указаний.
Экспериментальная установка
Вид и схема виртуальной экспериментальной установки для исследования эффекта Джоуля-Томсона в углекислом газе представлены на рисунках 5 и 6.
 Основным элементом установки является трубка 1 с пористой перегородкой 2, через которую пропускается исследуемый газ. Трубка сделана из материала, обладающего малой теплопроводностью. Пористая перегородка 2 расположена в конце трубки и представляет собой стеклянную пористую пробку с множеством узких и длинных каналов. Пористость и толщина пробки подобраны так, чтобы обеспечить оптимальный поток газа при перепаде давлений до 10 атм.; при этом в результате эффекта Джоуля-Томсона создается достаточная разность температур.
Основным элементом установки является трубка 1 с пористой перегородкой 2, через которую пропускается исследуемый газ. Трубка сделана из материала, обладающего малой теплопроводностью. Пористая перегородка 2 расположена в конце трубки и представляет собой стеклянную пористую пробку с множеством узких и длинных каналов. Пористость и толщина пробки подобраны так, чтобы обеспечить оптимальный поток газа при перепаде давлений до 10 атм.; при этом в результате эффекта Джоуля-Томсона создается достаточная разность температур.
Газ поступает в трубку из термостатического объёма 8, в котором нагревается змеевик 9 до температуры воды в термостате.
Температура воды измеряется термопарой 11 и отображается на индикаторе 7a пульта 7, разность температур до и после перегородки измеряется дифференциальной термопарой 4 и отображается на индикаторе 6.
Газ поступает в систему из баллона 13 через редуктор 12, который позволяет регулировать давление газа в магистрали.
Кран 10 позволяет перекрыть поток газа, давление контролируется манометром 11.ТЭН управляется с пульта 7. Пульт содержит задатчик температуры (в °С), переключатели "НАГРЕВ" и "ЦИРК".
Переключатель "НАГРЕВ" включает режим поддержания температуры воды внутри термостата равной заданной, при выключенном переключателе "НАГРЕВ" температура воды устанавливается равной комнатной. Индикацией включения нагрева является окрашивание в красный цвет изображения ТЭНа внутри термостата. Переключатель "ЦИРК" включает или выключает циркуляцию воды через водяную рубашку трубы 1.
Индикацией включения циркуляции является вращение крыльчатки насоса внутри термостата.
 |
В процессе протекания через пористую перегородку газ испытывает существенное трение, приводящее к ее нагреву. Потери энергии на нагрев трубки в начале процесса могут быть очень существенными и сильно искажают ход явления.
После того как температура трубки установится и газ станет уносить с собой все выделенное им в перегородке тепло, формула (17) становится точной, если, конечно, теплоизоляция трубки достаточно хороша и не происходит утечек тепла наружу через ее стенки.
Порядок выполнения работы
1. Запустите работу.
2. Установите на пульте термостата температуру регулирования 20 °С.
3. Включите термостат в режим "НАГРЕВ" и "ЦИРК".
4. Откройте регулирующий вентиль 12 настолько, чтобы избыточное давление составило 8¸10 атм.
5. Запишите показания манометра 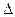 Р.
Р.
6. Откройте кран 10.
7. Через несколько минут после подачи давления, когда полностью затухнут переходные процессы, запишите показания дифференциального термометра 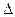 Т.
Т.
8. При помощи вентиля 12 установите давление на 1 атм. меньше первоначального.
9. Через несколько минут, когда установятся давление и разность температур, вновь запишите показания манометра и дифференциального термометра 6.
10. Проведите измерения для нескольких (5-7) значений давления при комнатной температуре.
11. Закройте кран 10, закончив измерения при комнатной температуре.
12. Установите на термостате температуру 40¸50 °C.
13. Когда температура установится и установка войдет в стационарный режим, повторите измерения, как указано в пунктах 3-10.
14. Проделайте такие же измерения, как указано в пунктах 3—10, для температуры 70¸80 °C.
Обработка результатов измерений
1. Занесите результаты измерений в таблицу 1.
Таблица 1 - Результаты измерений и вычислений
| Физическая величина | Т | 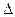 Р Р
| 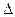 Т Т
| m | a | b | Тинв | Ткр |
| Единицы измерений Номер опыта | оС | Па | оС | 
| 
| 
| К | К |
| … | ||||||||
| n |
2. Из экспериментальных данных определить пределы изменения аргумента 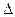 Р и функции
Р и функции 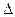 Т.
Т.
3. На координатных осях указать откладываемые физические величины и обозначить единицы величин.
4. Указать масштаб на осях координат (при очень больших или очень малых величинах, показательную часть в записи величины указать рядом с единицами измерений на оси).
5. Нанести полученные экспериментальные данные на координатную плоскость, обозначив их крестиком, кружочком, или жирной точкой.
6. Провести через экспериментальные точки плавную линию, в соответствии с выбранным законом аппроксимации экспериментальных данных, по методу наименьших квадратов.
7. На графике  , по наклону линии определить коэффициент Джоуля-Томсона для выбранной вами температуры.
, по наклону линии определить коэффициент Джоуля-Томсона для выбранной вами температуры.
8. Определить температуру инверсии Тинв и критическую температуру Ткр для углекислого газа используя данные таблицы 4 и формулы (29-30) раздела I.
9. Исследовать знак эффекта, выявить существующие зависимости между величинами.
10. По двум парам температур дифференциального термометра получить формулы для определения постоянных a и b для углекислого газа, используя формулу  и экспериментальные данные, полученные при трех значениях выбранных температур. (
и экспериментальные данные, полученные при трех значениях выбранных температур. ( , R – газовая постоянная).
, R – газовая постоянная).
11. Определить температуру инверсии Тинв и критическую температуру Ткр для углекислого газа используя вычисленные значения постоянных a и b и формулы (29-30) раздела I.
12. Определить абсолютные погрешности прямых измерений.
13. Вывести формулы для оценки максимальной абсолютной и относительной погрешности косвенных измерений.
14. Выполнить оценку максимальной абсолютной и относительной погрешности косвенных измерений.
15. Выполнить сравнительную оценку экспериментальных и справочных результатов.
По указанию преподавателя студент может самостоятельно, опираясь на имеющиеся теоретические знания, методическую и справочную литературу, подобрать метод обработки и анализа экспериментальных данных, математический метод решения задачи аппроксимации, а также выбрать характеристики для оценки погрешности результатов измерения.
Контрольные вопросы
1. Как силы межмолекулярного взаимодействия зависят от расстояния между молекулами?
2. Укажите соотношения между минимальной потенциальной энергией двух молекул и средней кинетической энергией хаотического движения молекулы для различных агрегатных состояний вещества.
3. Из каких предпосылок выводится уравнение Ван-дер-Ваальса?
4. Каков физический смысл постоянных Ван-дер-Ваальса? Какое значение принимают эти постоянные для идеального газа?
5. Что такое внутреннее давление?
6. Объясните различие опытных изотерм реального газа и изотерм, соответствующих уравнению Ван-дер-Ваальса.
7. При каких условиях возникает критическое состояние вещества и в чем оно проявляется?
8. Объясните эффект Джоуля-Томсона.
9. Какой из эффектов Джоуля-Томсона называют положительным, а какой отрицательным?
10.Азот массой т = 300 г, находится в сосуде объемом V = 0,5 л при температуре t = 27 °С. Можно ли считать азот в таком состоянии идеальным газом или нет?
11. Найдите выражение для коэффициента Джоуля-Томсона в двух случаях: а) силы межмолекулярного притяжения отсутствуют, б) объем молекул не учитывается.
12.Что можно сказать на основании ваших измерений Тинв и Ткр о точности уравнения Ван-дер-Ваальса?
3. ТРЕБОВАНИЯ К СОДЕРЖАНИЮ ОТЧЁТА
ПО ЛАБОРАТОРНОЙ РАБОТЕ
Отчёт оформляется в печатном виде на листах формата А4 в соответствии с требованиями, предъявляемыми кафедрой ОТФ, в котором помимо стандартного титульного листа должны быть раскрыты следующие пункты:
I. Цель работы.
II. Краткое теоретическое содержание:
1. Явление, изучаемое в работе.
2. Определение основных физических понятий, объектов, процессов и величин.
3. Законы и соотношения, описывающие изучаемые процессы, на основании которых получены расчётные формулы.
4. Пояснения к физическим величинам и их единицы измерений.
III. Схема установки.
IV. Расчётные формулы.
V. Формулы погрешностей косвенных измерений.
VI. Таблицы с результатами измерений и вычислений.
(Таблицы должны иметь номер и название. Единицы измерения физических величин должны быть указаны в отдельной строке.)
VII. Пример вычисления (для одного опыта):
1. Исходные данные.
2. Вычисления.
3. Окончательный результат.
VIII. Графический материал.
1. Аналитическое выражение функциональной зависимости, которую необходимо построить.
2. На осях координат указать масштаб, физические величины и единицы измерения.
3. На координатной плоскости должны быть нанесены экспериментальные точки.
4. По результатам эксперимента, представленным на координатной плоскости, провести плавную линию, аппроксимирующую функциональную теоретическую зависимость в соответствии с методом наименьших квадратов.
IX. Анализ полученного результата. Выводы.
4. РЕКОМЕНДАЦИИ ПО ЗАЩИТЕ ОТЧЕТА
К защите допускаются студенты, подготовившие отчет в соответствии с требованиями к его содержанию в установленные сроки. После проверки преподавателем содержания отчёта, при наличии ошибок и недочетов, работа возвращается студенту на доработку.
При правильном выполнении лабораторной работы, соблюдении всех требований к содержанию и оформлению отчёта, студент допускается к защите.
Для успешной защиты отчета необходимо изучить теоретический материал по теме работы, а так же освоить математический аппарат, необходимый для вывода расчетных формул работы.
При подготовке к защите, помимо данного методического указания, необходимо использовать учебники и другие учебные пособия, рекомендованные к учебному процессу кафедрой ОТФ и Министерством образования и науки.
Во время защиты студент должен уметь ответить на вопросы преподавателя в полном объёме теоретического и методического содержания данной лабораторной работы, уметь самостоятельно вывести необходимые расчётные формулы, выполнить анализ полученных зависимостей и прокомментировать полученные результаты.
5. ПРИЛОЖЕНИЕ
Таблица 
 2 - Множители и приставки для образования десятичных и кратных единиц
2 - Множители и приставки для образования десятичных и кратных единиц
| Множи-тель | Приставка | Множи-тель | Приставка | ||
| Наимено-вание | Обозна-чение | Наимено-вание | Обозна-чение | ||
| 1012 | Тера | Т | 10-2 | Санти | с |
| 109 | Гига | Г | 10-3 | Милли | м |
| 106 | Мега | М | 10-6 | Микро | мк |
| 103 | Кило | к | 10-9 | Нано | н |
| 10-1 | Деци | д | 10-12 | Пико | п |
Таблица 3 - Основные физические постоянные
| Физическая величина | Численное значение |
| Атомная единица массы (унифицированная) | 1 у.а.е.м. = 1,660531(11) × 10-27 кг= = 931,481(52) МэВ |
| Давление атмосферное нормальное | p 0 = 1,01325 × 105 Па |
| Молярная газовая постоянная | R = 8,31441(26) Дж/(К×моль) |
| Объем идеального газа при нормальных условиях | V 0 = 22,4136 × 10-3 м3/моль |
| Постоянная Больцмана | k = R / NA = 1,380622(59) × 10-23 Дж/К |
| Ускорение свободного падения | g = 9,80665 м/с |
| Число Авогадро | NА = 6,022169(40) × 1023 моль-1 |
Таблица 4 - Критические параметры и поправки Ван-дер-Ваальса
| Газ | Критическая температура Ткр ,К | Критическое давление pкр, МПа | Поправки Ван-дер-Ваальса | |
| а, Н×м4/моль2 | b, 10-5 м3/моль | |||
| Азот | 3,39 | 0,135 | 3,86 | |
| Аргон | 4,86 | 0,134 | 3,22 | |
| Водяной пар | 22,1 | 0,545 | 3,04 | |
| Кислород | 5,08 | 0,136 | 3,17 | |
| Неон | 44,4 | 2,72 | 0,209 | 1,70 |
| Углекислый газ | 7,38 | 0,361 | 4,28 | |
| Хлор | 7,71 | 0,650 | 5,62 | |
| Гелий | 5,19 | 0,227 | 0,0035 | 2,37 |
| Водород | 33,24 | 1,30 | 0,0247 | 2,66 |
| Метан | 190,66 | 4,63 | 0,229 | 4,28 |
6. РЕКОМЕНДАТЕЛЬНЫЙ
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Основная литература
1. Савельев И.В. Курс физики. Т. 1. СПб.: М.: Лань, 2008.
2. Трофимова Т.И. Курс физики. М.: Высшая школа, 2009.
3. Трофимова Т.И. Краткий курс физики. М.: Высшая школа, 2010.
Базы данных, информационно-справочные и поисковые системы.
4. Информационная система «Единое окно доступа к образовательным ресурсам» (http://window.edu.ru/).
5. Научная Электронная Библиотека http://www.e-library.ru.
6. Электронные версии учебников, пособий, методических разработок, указаний и рекомендаций по всем видам учебной работы, предусмотренных вузовской рабочей программой, находящиеся в свободном доступе для студентов, обучающихся в вузе, на внутри сетевом сервере http://www.spmi.ru/.
СОДЕРЖАНИЕ
Введение………………………………………………………………....3
1. Реальные газы………………………………………………………...5
1.1. Силы межмолекулярного взаимодействия……………………….5
1.2. Уравнение Ван-дер-Ваальса……………………………………….6
1.3. Внутренняяэнергия реального газа……………………………...10
1.4. Эффект Джоуля – Томсона……………………………………….11
2. Лабораторная работа. Исследование эффекта Джоуля - Томпсона при адиабатическом истечении газа………………………………….15
3. Требования к содержанию отчётапо лабораторной работе……...21
4. Рекомендации по защите отчета…………………………………...22
5. Приложение………………………………………………………....23
6. Рекомендательный библиографический список………………….24






