Тема 3. Ферменты
Лекция 5. Ферменты
Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов.
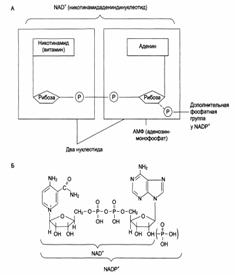
2. Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов.
3. Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
Классификация и номенклатура ферментов. Изоферменты. Органоспецифические ферменты. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты. Наследственные энзимопатии.
Практическое значение анализа изоферментных спектров в крови (ЛДГ, КК и др.). Применение ферментов как аналитических реагентов при лабораторной диагностике.
| Краткое содержание | Конспект | |
| 1. Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов | ||
Ферменты являются белковыми катализаторами биохимических реакций, т.е. они являются реакционно-специфическими катализаторами.
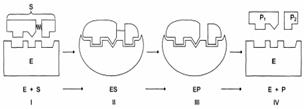
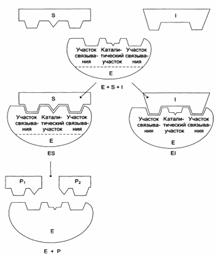
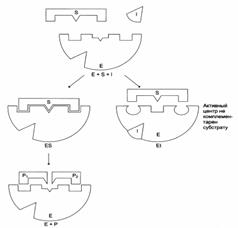
Схема процесса катализа:
Е + S ↔ ES ↔ EP → E + P
Свойства ферментов:1.Специфичность. 2.Каталитическая эффективность. 3. Лабильность ферментов. 4. Способность ферментов к регуляции. 5. Высокий коэффициент полезного действия (100 %).
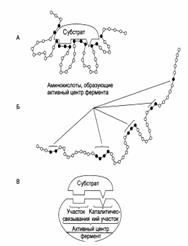
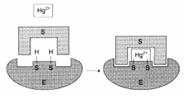
Строение активного центра фермента:
Этапы ферментативного катализа:
|
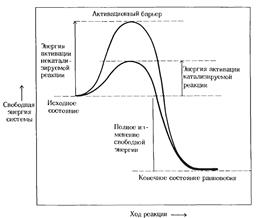
Энергия активации
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
Разницу энергий между исходным реагентом и конечными продуктами называют изменением свободной энергии реакции (ΔG).
| Зависимость скорости ферментативной реакции (V) от концентрации фермента: | 
|
| Зависимость скорости ферментативной реакции (V) от температуры: | 
|
| Зависимость скорости ферментативной реакции (V) от рН среды: | 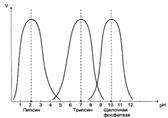
|
Единицы активности ферментов
Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции.
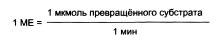
В 1973 г. была принята новая единица активности ферментов: 1 кат (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяю по формуле:

В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности – МЕ.
Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд.ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:

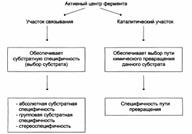
Специфичность ферментов: субстратная, каталитическая.
Субстратная специфичность
Субстратная специфичность – это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Выделяют три вида субстратной специфичности: 1. Абсолютная. 2. Групповая. 3. Стереоспецифичность.
1. Абсолютная субстратная специфичность:
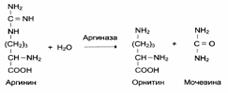
2. Групповая субстратная специфичность:
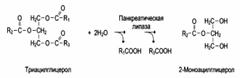
3. В организме человека наблюдается специфичность ферментов к следующим стереоизомерам: 1) к D-сахарам; 2) цис-транс-изомерам; 3) к L-аминокислотам; 4) к α- и β-гликозидным связям.
Стереоспецифичность к D-сахарам:
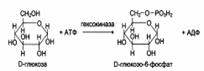
 Каталитическая специфичность
Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата: