Питательной средой в микробиологии называют среды, содержащие различные соединения сложного или простого состава, которые применяются для размножения бактерий или других микроорганизмов в лабораторных или промышленных условиях.
Питательные среды готовят из продуктов животного или растительного происхождения. Большое значение имеет наличие в питательной среде ростовых факторов, которые катализируют метаболические процессы микробной клетки (витамины группы В, никотиновая кислота и др.).
Искусственные среды готовят по определенным рецептам из различных настоев или отваров животного или растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ.
В бактериологической практике чаще всего используют сухие питательные среды, которые получают на основе достижений современной биотехнологии. Для их приготовления используют экономически рентабельное непищевое сырье: утратившие срок годности кровезаменители (гидролизин — кислотный гидролизат крови животных, аминопептид — ферментативный гидролизат крови; продукты биотехнологии (кормовые дрожжи, кормовой лизин, виноградная мука, белколизин). Сухие питательные среды могут храниться в течение длительного времени, удобны при транспортировке и имеют относительно стандартный состав.
По консистенции питательные среды могут быть жидкими, полужидкими, плотными. Плотные среды готовят путем добавления к жидкой среде 1,5—2% агара, полужидкие — 0,3— 0,7 % агара. Агар представляет собой продукт переработки особого вида морских водорослей, он плавится при температуре 80—86 °С, затвердевает при температуре около 40 °С и в застывшем состоянии придает среде плотность. В некоторых случаях для получения плотных питательных сред используют желатин (10—15%). Ряд естественных питательных сред (свернутая сыворотка крови, свернутый яичный белок) сами по себе являются плотными.
По целевому назначению среды подразделяют на основные, элективные и дифференциально-диагностические.
К основным относятся среды, применяемые для выращивания многих бактерий. Это триптические гидролизаты мясных, рыбных продуктов, крови животных или казеина, из которых готовят жидкую среду — питательный бульон и плотную — питательный агар. Такие среды служат основой для приготовления сложных питательных сред — сахарных, кровяных и др., удовлетворяющих пищевые потребности патогенных бактерий.
Элективные питательные среды предназначены для избирательного выделения и накопления микроорганизмов определенного вида (или определенной группы) из материалов, содержащих разнообразную постороннюю микрофлору. При создании элективных питательных сред исходят из биологических особенностей, которые отличают данные микроорганизмы от большинства других. Например, избирательный рост стафилококков наблюдается при повышенной концентрации хлорида натрия, холерного вибриона — в щелочной среде и т. д.
Дифференциально-диагностические питательные среды применяются для разграничения отдельных видов (или групп) микроорганизмов. Принцип построения этих сред основан на том, что разные виды бактерий различаются между собой по биохимической активности вследствие неодинакового набора ферментов.
Особую группу составляют синтетические и полусинтетические питательные среды. В состав синтетических сред входят химически чистые вещества: аминокислоты, минеральные соли, углеводы, витамины. В полусинтетические среды дополнительно включают пептон, дрожжевой экстракт и другие питательные вещества. Эти среды чаще всего применяют в научно-исследовательской работе и в микробиологической промышленности при получении антибиотиков, вакцин и других препаратов.
В последние годы в целях экономии питательных сред и ускоренной идентификации некоторых микроорганизмов (энтеробактерии, стафилококки, стрептококки и др.) применяются так называемые микротест-системы(МТС). Они представляют собой полистироловые пластины с лунками, в которых содержатся стерильные дифференциально-диагностические среды. Стерилизацию МТС проводят УФ-облучением. Микротест-системы особенно удобны при массовых бактериологических исследованиях в практических лабораториях.
Требования, предъявляемые к питательным средам.
Любая питательная среда должна отвечать следующим требованиям: содержать все необходимые для размножения микроорганизмов вещества в легкоусвояемой форме; иметь оптимальные влажность, вязкость, рН, быть изотоничной и по возможности прозрачной. Каждую питательную среду стерилизуют определенным способом в зависимости от ее состава.
10 классификация питательных сред по происхождению, составу, консистенции и названию. Культурные свойства микробов.
Классификация питательных сред
1. По консистенции: жидкие, полужидкие, плотные
Необходимая плотность сред создается добавлением к жидким средам 2-3% агара (агар-агар состоит из полисахаридов, получаемых из морских водорослей), обладает способностью растворяться при 100°С и застывать при комнатной температуре, создавая консистенцию геля.
2. По происхождению:
1. естественные среды готовят из натуральных продуктов (картофель, морковь, яйца, сыворотка крови и т.д.).
2. искусственные состоят из переработанных естественных продуктов (картофельный отвар, мясной бульон и т.д.) и вещества, которые получены из натуральных продуктов (пептон, дрожжевой экстракт и т.д.).
3. синтетические создают из чистых химических соединений с точно известным составом (аминокислоты, углеводы, витамины, минеральные соли) (например, минимальный агар, который содержит в качестве источника азота - (NH4)2SO4, а в качестве источника углерода – глюкозу).
3. По составу: 1 ) белковые, 2) безбелковые, 3) минеральные
4. По целевому назначению:
1. основные (простые или универсальные) – используются как самостоятельные питательные среды или в качестве питательной основы для специальных питательных сред и состоят из мясо-пептонного агара (МПА), мясо-пептонного бульона (МПБ). Такие среды готовят на основе мясного отвара с добавлением пептона, NaCl, определенного количества агара, с определенным значением pH.
2. специальные питательные среды в зависимости от цели использования подразделяют:
1. сложные – с обогащением простым сред углеводами (сахарный агар, сахарный бульон) или белками (кровяной агар, сывороточный агар или бульон, асцит-агар или асцит-бульон).
2. элективные (или избирательные) – среды, предназначенные для создания оптимальных условий для культивирования микроорганизмов определенного вида:
1. щелочной агар или щелочная пептонная вода 1% – элективность для холерного вибриона обусловлена созданием щелочной pH среды (8,0 – 8,2) в рамках которой происходит максимально быстрое размножение только данных микроорганизмов;
2. среда Ру, среда Леффлера – содержат свернутую сыворотку, необходимую для максимально быстрого роста дифтерийной палочки в сравнении с другими микроорганизмами.
3. селективные – содержащие в своем составе компоненты избирательно подавляющие рост посторонних микроорганизмов, не влияя на рост микроорганизмов искомого рода или вида:
1. селенитовая среда – с добавлением селенистого натра, для накопления патогенных шигелл, блокируя при этом рост посторонней энтерофлоры;
2. стафилококковый агар – с повышенным содержанием NaCl (до 20%), предназначена для роста и выделения стафилококков, блокируя при этом рост других микроорганизмов, не способных к размножению в повышенных концентрациях соли.
4. элективно-дифференциальные – сочетающие избирательность размножения определенных микроорганизмов и при этом возможность дифференцировать их в зависимости от характера роста:
1. желточно-солевой агар (ЖСА) – элективен для стафилококков за счет повышенного содержания NaCl и содержит лецитин для дифференциации лецитиназопозитивных (S. aureus ) и лецитиназонегативных стафилококков;
2. среда Плоскирева – обуславливает избирательный рост патогенных энтеробактерий и позволяет дифференцировать лактозопозитивные и лактозонегативные микроорганизмы.
5. дифференциально-диагностические, содержащие в своем составе питательную основу, субстрат расщепления (по которому проводится дифференциация, например, лактоза) и индикатор. Данные среды позволяют дифференцировать между собой микроорганизмы одного рода или вида по определенному признаку:
1. среда Эндо и среда Левина – для дифференциации лактозопозитивных и лактозонегативных микроорганизмов;
2. среды Гисса – для дифференциации способности расщепления различных углеводов (сахаролитические свойства микроорганизмов).
6. транспортные – предназначены для транспортировки взятого материала в бактериологическую лабораторию, например, тиогликолевая среда с резазурином, сердечно-мозговой агар и др.
7. среды для культивирования облигатно-анаэробных микроорганизмов – среды, предназначенные для культивирования микроорганизмов в условиях создания строго искусственного анаэробиоза, например, среда Вильсон-Блёр, среда Цейсслера, клостридиум-агар, кровяной агар бактероидов (КАБ) и др.
Культуральные свойства бактерий
При росте на жидких питательных средах бактерии чаще всего вызывают равномерное помутнение, иногда — выпадение осадка: крошковатого (стрептококки), хлопьевидного (стрептобациллы), бульон при этом остается прозрачным. Некоторые бактерии образуют пленку на поверхности жидкой среды: сухую чешуйчато-бородавчатую (туберкулезная палочка), тонкую, нежную (холерный вибрион), рыхлую, с отходящими вниз отростками — «сталактитами» (возбудитель чумы). Еще более разнообразен рост бактерий на плотных питательных средах. Образуемые при этом колонии различаются по многим признакам: размерам, форме, консистенции, структуре, прозрачности, цвету и др.
Колонии бывают очень мелкими (0,1-0,5 мм), мелкими (0,5-3,0 мм), средних размеров (3-5 мм) и крупными (более 5 мм в диаметре). Они могут быть круглыми (дисковидными); плоскими; иметь форму, напоминающую львиную гриву («голову Медузы»); ризоидными и т. п.. Края колонии могут быть гладкими, зазубренными, фестончатыми, изрезанными. Поверхность колонии бывает гладкая или шероховатая, влажная или сухая, ровная или складчатая, плоская или выпуклая, а ее консистенция — плотная, рыхлая, слизистая. Колонии могут быть прозрачными, полупрозрачными, непрозрачными и различаться по другим признакам, например у некоторых бактерий центр мутный, а периферическая зона полупрозрачна.
Все эти признаки, как правило, видоспецифичны, поэтому они имеют важное диагностическое значение, т. е. их изучение используется для определения видовой принадлежности исследуемой культуры. Например, при определенных условиях роста колонии Salmonella paratyphi В имеют характерный слизистый валик по периферии, напоминая пуговицу с валиком.
Колонию бактерий можно рассматривать как своеобразный сложный организм. Изучение организации колонии выявило морфологическую и физиологическую гетерогенность входящих в нее клеток. В колониях сосуществуют популяции активно размножающихся, покоящихся клеток и клеток лизирующихся. Видовое своеобразие свойств колоний указывает на регулируемый характер процесса их формирования. Он управляется с помощью контактных, дистантных и, вероятно, иных сигналов и служит проявлением у бактерий апоптоза. Постоянное наблюдение за бактериями на экране монитора требует регулярного обслуживания компьютеров.
Апоптоз (греч. apoptosis — опадание лепестков цветов или листьев дерева) — форма запрограммированной клеточной гибели у эукариот, благодаря которой удаляются определенные клоны дифференцирующихся клеток или «излишки» биологического материала. Апоптоз у бактерий — аналог апоптоза эукариот — пример запрограммированного контроля над клетками на уровне популяции (колония, стационарная культура, популяции в других природных условиях). Суть его сводится к тому, что при исчерпании питательного субстрата голодающая популяция разделяется на две субпопуляции, одна из которых гибнет и подвергается автолизу, а клетки другой субпопуляции, используя продукты автолиза как субстрат, продолжают размножаться.
Механизм генетического контроля апоптоза у Е. coli установлен. Он осуществляется особым опероном из 2 генов: mazE и mazF. Продукт гена mazF — стабильный цитотоксический белок-киллер, а продукт гена mazE — нестабильный белок MazE, разрушающий белок-киллер. Истощение фонда аминокислот в питательной среде приводит к блокированию оперона maz, в результате этого синтез белка MazE прекращается, а белок-киллер вызывает гибель и автолиз части популяции. Фонд аминокислот в среде за счет этого пополняется, синтез белка MazE у оставшихся живых клеток активируется, и они продолжают размножаться. Таким образом, апоптоз регулирует формирование колоний и поведение клеток в стационарных культурах. Возможно, этот механизм причастен и к образованию НФБ.
Культуры некоторых видов бактерий обладают характерным запахом, иногда он связан с разложением органических веществ, которое сопровождается образованием скатола, индола, сероводорода, меркаптана, масляной кислоты, аммиака и т. п. Культуры дизентерийных бактерий при росте на МПА издают запах, напоминающий запах мужского семени. Продукты жизнедеятельности ряда других видов бактерий обладают приятным ароматным запахом, который связан с образованием различных эфиров: уксусно-этилового, уксусно-амилового или диацетила. Возбудитель мочки льна, например, издает запах ананаса. Особые расы молочнокислых бактерий придают аромат пищевым продуктам.
В природе существуют так называемые фосфоресцирующие бактерии, т. е. бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым цветом. Такие фосфоресцирующие бактерии встречаются, главным образом, в морской и речной воде. Фосфоресценция (люминесценция) продолжается иногда несколько часов и даже суток. Она представляет собой особую форму освобождения энергии возбужденных электронов. Такие бактерии нередко обнаруживаются на мясе, чешуе рыб и других объектах. К светящимся бактериям — фотобактериям — относятся физиологически сходные, но морфологически отличающиеся аэробные бактерии (вибрионы, палочки, кокки).
Биохимические свойства бактерий можно начинать изучать одновременно с выделением культуры, засевая материал на специальные питательные среды, позволяющие судить о биохимической активности выделяемых микроорганизмов.
11 бактериологический метод диагностики инфекционных заболеваний.
Бактериоскопический (микроскопический) метод - совокупность способов обнаружения и изучения морфологических и тинкториальных свойств бактерий (микробов) в лабораторной культуре, патологическом материале или пробах из внешней среды с помощью микроскопии. Применяют для установления диагноза инфекционного заболевания или иного вызванного микробами процесса, а также при идентификации выделенной чистой культуры. Метод бактериоскопического исследования приобретает особое значение, если микроб имеет морфологические и тинкториальные особенности или особую локализацию в тканях, клетках организма. Только при некоторых инфекциях для постановки диагноза достаточно морфологического исследования.
Для диагностики большинства инфекций микроскопия, как первый этап микробиологического исследования, имеет лишь вспомогательное, ориентировочное значение.
Ценность бактериоскопического метода состоит в простоте, доступности методик и быстроте получения результатов (30-60 минут и менее). Однако специфичность его в связи с близостью морфологии разных видов мала, а чувствительность ограничена - разрешающая способность метода составляет в среднем 100 000 клеток в мл.
Микроскопические методы заключаются в приготовлении микроскопических препаратов для микроскопирования (нативных или окрашенных простыми и сложными способами) из исследуемого материала и их микроскопирование с применениемразличных видов микроскопической техники (световая, темно-польная, фазово-контрастная, люминесцентная. электронная). В большинстве случаев результаты микроскопических исследований носят ориентировочный характер. Тем не менее, микроскопией материала можно определить некоторые морфологические признаки возбудителей (наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах.

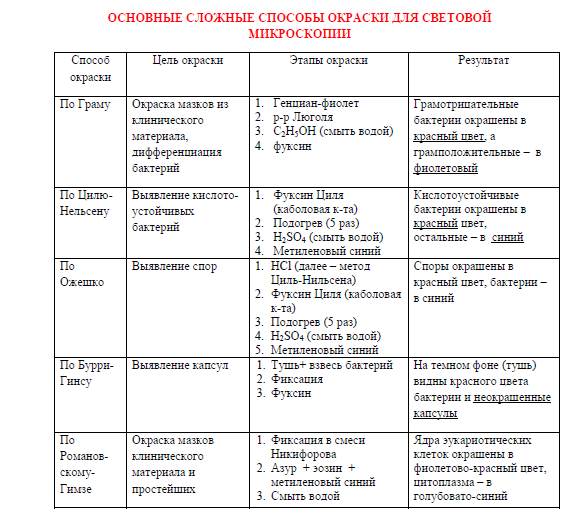
БАКТЕРИОЛОГИЧЕСКИЕМЕТОДЫ
Классическое бактериологическое (вирусологическое, микологическое) исследование (называемое «золотым стандартом» микробиологической диагностики). Его целью является выделение и идентификация возбудителя.
Алгоритм бактериологического (вирусологического, микологического) исследования складывается из следующих основных этапов:
1) первичная микроскопия (необязательный);
2) первичный посев для выделения чистой культуры;
3) накопление чистой культуры;
4) изучение комплекса биологических свойств выделенной культуры и ее идентификация. Идентификацию чистых культур (до вида микроорганизма) проводят с учётом морфологических, тинкториальных, культуральных, биохимических, токсигенных и антигенных свойств микроорганизма. Большинство исследований включает определение чувствительности к антимикробным препаратам у выделенного возбудителя. Для эпидемиологической оценки роли микроорганизма проводят внутривидовую идентификацию определением фаговаров, биоваров, резистентваров и т.д.
Классическое микробиологическое исследование имеет ряд недостатков. Прежде всего, это достаточно длительный процесс. Его минимальный срок 3-4 дня, но могут пройти многие дни и даже недели, прежде чем выделенный возбудитель будет точно идентифицирован. Для некоторых патогенных бактерий (холерного вибриона, дифтерийных бактерий) разработаны ускоренные методы выделения и идентификации, но и они позволяют получить ответ не ранее 36-48 часов.
Задача микробиологических исследований — выделить из исследуемого материала микроорганизмы и идентифицировать, то есть определить их видовую принадлежность.
Основой микробиологических исследований является бактериологический метод диагностики, суть которого – выделение микроорганизмов в чистой культуре и их идентификация.
Патогенные свойства для идентификации: ферменты патогенности – лецитиназа, плазмакоагулаза и пр.; токсигенность – способность продуцировать экзотоксины (дифтерийная палочка, золотистый стафилококк)
Антигенные (серологические)
Фаголизабельность – способность лизироваться бактериофагами (вирусами бактерий): чувствительность к лечебным фагам (для лечения инфекционного заболевания) и чувствительность к диагностическим фагам (видовым, типовым); фаготипирование – определение чувствительности к типовым фагам, проводится с целью определения источника и путей распространения микроорганизмов в окружающей среде или среди коллектива
Бактерициночувствительность и бактериоциногения: проводиться с целью определения источника и путей распространения микроорганизмов в окружающей среде или среди коллектива
Чувствительность к антимикробным препаратам: антибиотикам,химиотерапевтическим препаратам и антисептикам, дезинфектантам.

Основной недостаток бактериологического метода — длительность исследования — от 3 до 5 суток, а в отдельных случаях и более.
Результаты многих диагностических исследований на предмет обнаружения возбудителей в значительной степени зависят от их вида, а также от времени и способа взятия патологического материала. Характер материала определяется клиническими особенностями заболевания: это должны быть те субстраты или биологические жидкости, в которых на данной стадии заболевания наиболее вероятно присутствие возбудителей. Успех проведения бактериологического метода во многом зависит от предварительного этапа, включающего забор исследуемого материала и его транспортировку, оформление направления в бактериологическую лабораторию.
БИОЛОГИЧЕСКИЕ МЕТОДЫ
Биологические методы направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение возбудителя (особенно при незначительном исходном содержании в исследуемом образце, или, когда возбудитель не может быть обнаружен методом посева, - например, при вирусных и риккетсиозных заболедваниях).
Животных заражают для выделения чистой культуры возбудителя в тех случаях, когда нельзя получить ее другими способами (например, при загрязнении исследуемых объектов посторонней микрофлорой, подавляющей рост возбудителя; при незначительном содержании микроорганизмов или переходе их в фильтрующиеся формы).
Методы включают заражение чувствительных лабораторных животных (чувствительных к предполагаемому возбудителю) исследуемым материалом с последующим выделением чистой культуры патогена либо установлением факта присутствия микробного токсина и его природы, либо воспроизводят характерную клиническую картину.
Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм—макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста.
Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели —кровь, кусочки различных органов, СМЖ, экссудат из различных полостей.
Недостатки: а) необходимость содержания вивария; б) длительность проведения исследования. Кроме того, даже при лабораторном заражении далеко не всегда удается выделить возбудителя, что особенно характерно для вирусных инфекций.
12 действие факторов окружающей среды на микроорганизмов.
Физические, химические и биологические факторы окружающей среды оказывают различное воздействие на микроорганизмы: бактерицидное — приводящее к гибели клетки; бактериостатическое — подавляющее размножение микроорганизмов; мутагенное — изменяющее наследственные свойства микробов.
1. Влияние физических факторов
Влияние температуры. Представители различных групп микроорганизмов развиваются при определенных диапазонах температур. Бактерии, растущие при низкой температуре, называют психрофилами; при средней (около 37 °С) — мезофилами; при высокой — термофилами.
Психрофильные микроорганизмы растут при температуре от -10 до 40 "С; температурный оптимум колеблется от 15 до 40 °С, приближаясь к температурному оптимуму мезофильных бактерий. К психрофилам относится большая группа сапрофитов — обитателей почвы, морей, пресных водоемов и сточных вод (железобактерии, псевдомонады, светящиеся бактерии, бациллы). Некоторые психрофилы могут вызывать порчу продуктов питания на холоде. Способностью расти при низких температурах обладают и некоторые патогенные бактерии (возбудитель псевдотуберкулеза размножается при температуре 4 "С, а возбудитель чумы — в диапазоне от 0 до 40 °С при оптимуме роста 25 °С). В зависимости от температуры культивирования свойства бактерий меняются. Так, Serratia marcescens образует при температуре 20-25 °С большее количество красного пигмента (продигиозана), чем при температуре 37 °С. Возбудитель чумы, выращенный при 25 °С, вирулентнее, чем при 37 "С. Синтез полисахаридов, в том числе капсульных, активизируется при более низких температурах культивирования.
Мезофилы растут в диапазоне температур от 10 до 47 °С, оптимум роста около 37 "С. Они включают в себя основную группу патогенных и условно-патогенных бактерий.
Термофильные бактерии развиваются при более высоких температурах (от 40 до 90 °С). На дне океана в горячих сульфидных водах живут бактерии, развивающиеся при температуре 250—300 °С и давлении 265 атм. Термофилы обитают в горячих источниках, участвуют в процессах самонагревания навоза, зерна, сена. Наличие большого количества термофилов в почве свидетельствует о ее загрязненности навозом и компостом. Поскольку навоз наиболее богат термофилами, их рассматривают как показатель загрязненности почвы.
Температурный фактор учитывается при осуществлении стерилизации. Вегетативные формы бактерий погибают при температуре 60 °С в течение 20—30 мин., споры — в автоклаве при 120 °С в условиях пара под давлением.
Микроорганизмы хорошо переносят действие низких температур. Поэтому их можно долго хранить в замороженном состоянии, в том числе при температуре жидкого азота (-173 °С).
Высушивание. Обезвоживание вызывает нарушение функций большинства микроорганизмов. Наиболее чувствительны к высушиванию возбудители гонореи, менингита, холеры, брюшного тифа, дизентерии и другие патогенные микроорганизмы. Более устойчивыми являются микроорганизмы, защищенные слизью мокроты. Так, бактерии туберкулеза в мокроте выдерживают высушивание до 90 дней. Устойчивы к высушиванию некоторые капсуло- и слизеобразующие бактерии. Особой устойчивостью обладают споры бактерий. Например, споры возбудителя сибирской язвы могут сохраняться в почве столетиями.
Для продления жизнеспособности, при консервировании микроорганизмов, используют лиофилизацию — высушивание под вакуумом из замороженного состояния. Лиофилизированные культуры микроорганизмов и иммунобиологические препараты длительно (в течение нескольких лет) сохраняются, не изменяя своих первоначальных свойств.
Действие излучения. Ионизирующее излучение применяют для стерилизации одноразовой пластиковой микробиологической посуды, питательных сред, перевязочных материалов, лекарственных препаратов и др. Однако имеются бактерии, устойчивые к действию ионизирующих излучении, например Micrococcus radiodurans был выделен из ядерного реактора.
Неионизирующее излучение — ультрафиолетовые и инфракрасные лучи солнечного света, а также ионизирующее излучение — гамма-излучение радиоактивных веществ и электроны высоких энергий губительно действуют на микроорганизмы уже через короткий промежуток времени.
Ультрафиолетовые лучи, достигающие поверхности земли, имеют длину волны 290 нм. УФ-лучи применяют для обеззараживания воздуха и различных предметов в больницах, родильных домах, микробиологических лабораториях. С этой целью используют бактерицидные лампы ультрафиолетового излучения с длиной волны 200—400 нм.
2. Влияние химических веществ
Химические вещества могут оказывать различное действие на микроорганизмы: служить источниками питания; не оказывать какого-либо влияния; стимулировать или подавлять рост; вызывать гибель. Антимикробные химические вещества используются в качестве антисептических и дезинфицирующих средств, так как обладают бактерицидным, вирулицидным, фунгицидным действием и т. д.
Химические вещества, используемые для дезинфекции, относятся к различным группам, среди которых наиболее широко представлены хлор-, йод- и бромсодержащие соединения и окислители.
3. Влияние биологических факторов. Микроорганизмы находятся в различных взаимоотношениях друг с другом. Совместное существование двух различных организмов называется симбиозом (от греч. simbiosis — совместная жизнь). Различают несколько вариантов полезных взаимоотношений: метабиоз, мутуализм, комменсализм, сателлизм.
Метабиоз — взаимоотношение микроорганизмов, при котором один из них использует для своей жизнедеятельности продукты жизнедеятельности другого. Метабиоз характерен для почвенных нитрифицирующих бактерий, использующих для своего метаболизма аммиак — продукт жизнедеятельности аммонифицирующих почвенных бактерий.
Мутуализм — взаимовыгодные взаимоотношения разных организмов. Примером мутуалистического симбиоза являются лишайники — симбиоз гриба и сине-зеленой водоросли. Получая от клеток водоросли органические вещества, гриб, в свою очередь, поставляет им минеральные соли и защищает от высыхания.
Комменсализм (от лат. commensalis — сотрапезник) — сожительство особей разных видов, при котором выгоду из симбиоза извлекает один вид, не причиняя другому вреда. Комменсалами являются бактерии — представители нормальной микрофлоры человека
Сателлизм — усиление роста одного вида микроорганизма под влиянием другого вида микроорганизма. Например, колонии дрожжей или сарцин, выделяя в питательную среду метаболиты, стимулируют рост вокруг них колоний других микроорганизмов. При совместном росте нескольких видов микроорганизмов могут активизироваться их физиологические функции и свойства, что приводит к более быстрому воздействию на субстрат.
Антагонистические взаимоотношения, или антагонистический симбиоз, выражаются в виде неблагоприятного воздействия одного вида микроорганизма на другой, приводящего к повреждению и даже гибели последнего. Микроорганизмы-антагонисты распространены в почве, воде и в организме человека и животных. Хорошо известна антагонистическая активность против посторонней и гнилостной микрофлоры представителей нормальной микрофлоры толстого кишечника человека — бифидобактерий, лактобактерий, кишечной палочки и др.
Механизм антагонистических взаимоотношений разнообразен. Распространенной формой антагонизма является образование антибиотиков — специфических продуктов обмена микроорганизмов, подавляющих развитие микроорганизмов других видов. Существуют и другие проявления антагонизма, например, большая скорость размножения, продукция бактериоцинов, в частности колицинов, продукция органических кислот и других продуктов, изменяющих рН среды.
Антагонизм может развиваться в форме конкуренции в основном за источники питания: интенсивно развиваясь и истощая питательную среду, микроорганизм-антагонист подавляет рост других микроорганизмов. При хищничестве микроорганизм, например, амеба кишечника, захватывает и переваривает бактерии кишечника. Наконец, такая форма антагонизма, когда микроорганизм использует другой организм как источник питания, называется паразитизмом. Примером паразитизма является взаимоотношение бактериофага и бактерии, а также взаимоотношение бделловибрионов (маленькие бактерии, паразиты обычных грамотрицательных бактерий).
13 понятие о стерилизации, дезинфекции, асептике и антисептике. Методы стерилизации и аппаратура. Понятие о микробоцидном и микробостатическом действии.
Влияние температуры. Различные группы микроорганизмов развиваются при определенных диапазонах температур. Бактерии, растущие при низкой температуре, называют психрофилами, при средней (около 37 °С) — мезофилами, при высокой — термофилами.
К психрофильным микроорганизмам относится большая группа сапрофитов — обитателей почвы, морей, пресных водоемов и сточных вод (железобактерии, псевдомонады, светящиеся бактерии, бациллы). Некоторые из них могут вызывать порчу продуктов питания на холоде. Способностью расти при низких температурах обладают и некоторые патогенные бактерии (возбудитель псевдотуберкулеза размножается при температуре 4 °С). В зависимости от температуры культивирования свойства бактерий меняются. Интервал температур, при котором возможен рост психрофильных бактерий, колеблется от -10 до 40 °С, а температурный оптимум — от 15 до 40 °С, приближаясь к температурному оптимуму мезофильных бактерий.
Мезофилы включают основную группу патогенных и условно-патогенных бактерий. Они растут в диапазоне температур 10— 47 °С; оптимум роста для большинства из них 37 °С.
При более высоких температурах (от 40 до 90 °С) развиваются термофильные бактерии. На дне океана в горячих сульфидных водах живут бактерии, развивающиеся при температуре 250—300 °С и давлении 262 атм.
Термофилы обитают в горячих источниках, участвуют в процессах самонагревания навоза, зерна, сена. Наличие большого количества термофилов в почве свидетельствует о ее загрязненности навозом и компостом. Поскольку навоз наиболее богат термофилами, их рассматривают как показатель загрязненности почвы.
Хорошо выдерживают микроорганизмы действие низких температур. Поэтому их можно долго хранить в замороженном состоянии, в том числе при температуре жидкого газа (—173 °С).
Высушивание. Обезвоживание вызывает нарушение функций большинства микроорганизмов. Наиболее чувствительны к высушиванию патогенные микроорганизмы (возбудители гонореи, менингита, холеры, брюшного тифа, дизентерии и др.). Более устойчивыми являются микроорганизмы, защищенные слизью мокроты.
Высушивание под вакуумом из замороженного состояния — лиофилизацию — используют для продления жизнеспособности, консервирования микроорганизмов. Лиофилизированные культуры микроорганизмов и иммунобиологические препараты длительно (в течение нескольких лет) сохраняются, не изменяя своих первоначальных свойств.
Действие излучения. Неионизирующее излучение — ультрафиолетовые и инфракрасные лучи солнечного света, а также ионизирующее излучение — гамма-излучение радиоактивных веществ и электроны высоких энергий губительно действуют на микроорганизмы через короткий промежуток времени. УФ-лучи применяют для обеззараживания воздуха и различных предметов в больницах, родильных домах, микробиологических лабораториях. С этой целью используют бактерицидные лампы УФ-излучения с длиной волны 200—450 нм.
Ионизирующее излучение применяют для стерилизации одноразовой пластиковой микробиологической посуды, питательных сред, перевязочных материалов, лекарственных препаратов и др. Однако имеются бактерии, устойчивые к действию ионизирующих излучений, например, Micrococcus radioduransбыла выделена из ядерного реактора.
Действие химических веществ. Химические вещества могут оказывать различное действие на микроорганизмы: служить источниками питания; не оказывать какого-либо влияния; стимулировать или подавлять рост. Химические вещества, уничтожающие микроорганизмы в окружающей среде, называются дезинфицирующими. Антимикробные химические вещества могут обладать бактерицидным, вирулицидным, фунгицидным действием и т.д.
Химические вещества, используемые для дезинфекции, относятся к различным группам, среди которых наиболее широко представлены вещества, относящиеся к хлор-, йод- и бромсодержащим соединениям и окислителям.
Стерилизация – предполагает полную инактивацию микробов в объектах, подвергшихся обработке.
Дезинфекция — процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смогли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии.
Асептика – комплекс мер, направленных на предупреждение попадания возбудителя инфекции в рану, органы больного при операциях, лечебных и диагностических процедурах. Методы асептики применяют для борьбы с экзогенной инфекцией, источниками которой являются больные и бактерионосители.
Антисептика – совокупность мер, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию воспалительного процесса.
Стерилизация предполагает полную инактивацию микробов в объектах, подвергающихся обработке.
Существует три основных метода стерилизации: тепловой, лучевой, химической.
Тепловая стерилизация основана на чувствительности микробов к высокой температуре. При 60 "С и наличии воды происходит денатурация белка, деградация нуклеиновых кислот, липидов, вследствие чего вегетативные формы микробов погибают. Споры, содержащие очень большое количество воды в связанном состоянии и обладающие плотными оболочками, инактивируются при 160—170 °С.
Для тепловой стерилизации применяют, в основном, сухой жар и пар под давлением.
Стерилизацию сухим жаром осуществляют в воздушных стерилизаторах (прежнее название — «сухожаровые шкафы или печи Пастера»). Воздушный стерилизатор представляет собой металлический плотно закрывающийся шкаф, нагревающийся с помощью электричества и снабженный термометром. Обеззараживание материала в нем производят, как правило, при 160 °С в течение 120 мин. Однако возможны и другие режимы: 200 °С - 30 мин, 180 "С - 40 мин.
Стерилизуют сухим жаром лабораторную посуду и другие изделия из стекла, инструменты, силиконовую резину, т. е. объекты, которые не теряют своих качеств при высокой температуре.
Большая часть стерилизуемых предметов не выдерживает подобной обработки, и поэтому их обеззараживают в паровых стерилизаторах.
Обработка паром под давлением в паровых стерилизаторах (старое название — «автоклавы») является наиболее универсальным методом стерилизации.
Паровой стерилизатор (существует множество его модификаций) — металлический цилиндр с прочными стенками, герметически закрывающийся, состоящий из водопаровой и стерилизующей камер. Аппарат снабжен манометром, термометром и другими контрольно-измерительными приборами. В автоклаве создается повышенное давление, что приводит к увеличению температуры кипения.
Поскольку кроме высокой температуры на микробы оказывает воздействие и пар, споры погибают уже при 120 °С. Наиболее распространенный режим работы парового стерилизатора: 2 атм — 121 °С — 15—20 мин. Время стерилизации уменьшается при повышении атмосферного давления, а, следовательно, и температуры кипения (136 °С — 5 мин). Микробы погибают за несколько секунд, но обработку материала производят в течение большего времени, так как, во-первых, высокая температура должна быть и внутри стерилизуемого материала и, во-вторых, существует так называемое поле безопасности (рассчитанное на небольшую неисправность автоклава).
Стерилизуют в автоклаве большую часть предметов: перевязочный материал, белье, коррозионно-устойчивые металлические инструменты, питательные среды, растворы, инфекционный материал и т. д.
Одной из разновидностей тепловой стерилизации является дробная стерилизация, которую применяют для обработки материалов, не выдерживающих температуру выше 100 °С, например, для стерилизации питательных сред с углеводами, желатина. Их нагревают в водяной бане при 80 °С в течение 30—60 мин.
В настоящее время применяют еще один метод тепловой стерилизации, предназначенный специально для молока — ультравысокотемпературный (УВТ): молоко обрабатывают в течение нескольких секунд при 130—150 °С.
Химическая стерилизация предполагает использование токсичных газов: оксида этилена, смеси ОБ (смеси оксида этилена и бромистого метила в весовом соотношении 1:2,5) и формальдегида. Эти вещества являются алкилирующими агентами, их способность в присутствии воды инактивировать активные группы в ферментах, других белках, ДНК и РНК приводит к гибели микроорганизмов.
Стерилизация газами осуществляется в присутствии пара при температуре от 18 до 80 °С в специальных камерах. В больницах используют формальдегид, в промышленных условиях — оксид этилена и смесь ОБ.
Перед химической стерилизацией все изделия, подлежащие обработке, должны быть высушены.
Этот вид стерилизации небезопасен для персонала, для окружающей среды и для пациентов, пользующихся простерилизованными предметами (большинство стерилизующих агентов остается на предметах).
Однако существуют объекты, которые могут быть повреждены нагреванием, например, оптические приборы, радио- и электронная аппаратура, предметы из нетермостойких полимеров, питательные среды с белком и т. п., для которых пригодна только химическая стерилизация. Например, космические корабли и спутники, укомплектованные точной аппаратурой, для их деконтаминации обезвреживают газовой смесью (оксид этилена и бромистого метила).
В последнее время в связи с широким распространением в медицинской практике изделий из термолабильных материалов, снабженных оптическими устройствами, например, эндоскопов, стали применять обезвреживание с помощью химических растворов. После очистки и дезинфекции прибор помещают на определенное время (от 45 до 60 мин) в стерилизующий раствор, затем прибор должен быть отмыт стерильной водой. Для стерилизации и отмывки используют стерильные емкости с крышками. Простерилизованное и отмытое от стерилизующего раствора изделие высушивают стерильными салфетками и помещают в стерильную емкость. Все манипуляции проводят в асептических условиях и в стерильных перчатках. Хранят эти изделия не более 3 суток.
Лучевая стерилизация осуществляется либо с помощью гамма-излучения, либо с помощью ускоренных электронов.
Лучевая стерилизация является альтернативой газовой стерилизации в промышленных условиях, и применяют ее также в тех случаях, когда стерилизуемые предметы не выдерживают высокой температуры. Лучевая стерилизация позволяет обрабатывать сразу большое количество предметов (например, одноразовых шприцев, систем для переливания крови). Благодаря возможности широкомасштабной стерилизации, применение этого метода вполне оправданно, несмотря на его экологическую опасность и неэкономичность.
Еще одним способом стерилизации является фильтрование. Фильтрование с помощью различных фильтров (керамических, асбестовых, стеклянных), а в особенности мембранных ультрафильтров из коллоидных растворов нитроцеллюкозы или других веществ позволяет освободить жидкости (сыворотку крови, лекарства) от бактерий, грибов, простейших и даже вирусов. Для ускорения процесса фильтрации обычно создают повышенное давление в емкости с фильтруемой жидкостью или пониженное давление в емкости с фильтратом.
В настоящее время все более широкое применение находят современные методы стерилизации, созданные на основе новых технологий, с использованием плазмы, озона.
14 строение генома бактерий. Понятие о геноме и фенотипе. Виды изменчивости.
Бактериальный геном состоит из генетических элементов, способных к самостоятельной репликации, т. е. репликонов. Репликонами являются бактериальная хромосома и плазмиды.
Наследственная информация хранится у бактерий в форме последовательности нуклеотидов ДНК, которые определяют последовательность аминокислот в белке. Каждому белку соответствует свой ген, т. е. дискретный участок на ДНК, отличающийся числом и специфичностью последовательности нуклеотидов.
Бактериальная хромосома представлена одной двухцепочечной молекулой ДНК кольцевой формы. Размеры бактериальной хромосомы у различных представителей царства Procaryotae варьируют. Бактериальная хромосома формирует компактный нуклеоид бактериальной клетки. Бактериальная хромосома имеет гаплоидный набор генов. Она кодирует жизненно важные для бактериальной клетки функции.
Плазмиды бактерий представляют собой двухцепочечные молекулы ДНК. Они кодируют не основные для жизнедеятельности бактериальной клетки функции, но придающие бактерии преимущества при попадании в неблагоприятные условия существования.
Свойства микроорганизмов, как и любых других организмов, определяются их генотипом, т.е. совокупностью генов данной особи. Термин «геном» в отношении микроорганизмов — почти синоним понятия «генотип».
Фенотип представляет собой результат взаимодействия между генотипом и окружающей средой, т. е. проявление генотипа в конкретных условиях обитания. Фенотип микроорганизмов хотя и зависит от окружающей среды, но контролируется генотипом, так как характер и степень возможных для данной клетки фенотипических изменений определяются набором генов, каждый из которых представлен определенным участком молекулы ДНК.
В основе изменчивости лежит либо изменение реакции генотипа на факторы окружающей среды, либо изменение самого генотипа в результате мутации генов или их рекомбинации. В связи с этим фенотипическую изменчивость подразделяют на наследственную и ненаследственную.
Ненаследственная (средовая, модификационная) изменчивость обусловлена влиянием внутри- и внеклеточных факторов на проявление генотипа. При устранении фактора, вызвавшего модификацию, данные изменения исчезают.
Наследственная (генотипическая) изменчивость, связанная с мутациями, — мутационная изменчивость. Основу мутации составляют изменения последовательности нуклеотидов в ДНК, полная или частичная их утрата, т. е. происходит структурная перестройка генов, проявляющаяся фенотипически в виде изменённого признака.
Наследственная изменчивость, связанная с рекомбинациями, называется рекомбинационной изменчивостью.
Подвижные генетические элементы.
В состав бактериального генома, как в бактериальную хромосому, так и в плазмиды, входят подвижные генетические элементы. К подвижным генетическим элементам относятся вставочные последовательности и транспозоны.
Вставочные (инсерционные) последовательности IS-элементы — это участки ДНК, способные как целое перемещаться из одного участка репликона в другой, а также между репликонами. Они содержат лишь те гены, которые необходимы для их собственного перемещения — транспозиции: ген, кодирующий фермент транспозазу, обеспечивающую процесс исключения IS-элемента из ДНК и его интеграцию в новый локус, и ген, детерминирующий синтез репрессора, который регулирует весь процесс перемещения.
Отличительной особенностью IS-элементов является наличие на концах вставочной последовательности инвертированных повторов. Эти инвертированные повторы узнает фермент транспозаза. Транспозаза осуществляет одноцепочечные разрывы цепей ДНК, расположенных по обе стороны от подвижного элемента. Оригинальная копия IS-элемента остается на прежнем месте, а ее реплицированный дупликат перемещается на новый участок.
Перемещение подвижных генетических элементов принято называть репликативной или незаконной рекомбинацией. Однако в отличие от бактериальной хромосомы и плазмид подвижные генетические элементы не являются самостоятельными репликонами, так как их репликация — составной элемент репликации ДНК репликона, в составе которого они находятся.
Известно несколько разновидностей IS-элементов, которые различаются по размерам и по типам и количеству инвертированных повторов.
Транспозоны — это сегменты ДНК, обладающие теми же свойствами, что и IS-элементы, но имеющие структурные гены, т. е. гены, обеспечивающие синтез молекул, обладающих специфическим биологическим свойством, например, токсичностью, или обеспечивающих устойчивость к антибиотикам.
Перемещаясь по репликону или между репликонами, подвижные генетические элементы вызывают:
1. Инактивацию генов тех участков ДНК, куда они, переместившись, встраиваются.
2. Образование повреждений генетического материала.
3. Слияние репликонов, т. е. встраивание плазмиды в хромосому.
4. Распространение генов в популяции бактерий, что может приводить к изменению биологических свойств популяции, смене возбудителей инфекционных заболеваний, а также способствует эволюционным процессам среди микробов.
Изменения бактериального генома, а следовательно, и свойств бактерий могут происходить в результате мутаций и рекомбинаций.






