ћ”–ћјЌ— »… √ќ—”ƒј–—“¬≈ЌЌџ… “≈’Ќ»„≈— »… ”Ќ»¬≈–—»“≈“
афедра химии
онтрольна€ работа є1
’»ћ»„≈— јя “≈–ћќƒ»Ќјћ» ј.
’»ћ»„≈— јя »Ќ≈“» ј » –ј¬Ќќ¬≈—»≈
по курсу Ђ’ими€ї
ћурманск
онтрольна€ работа 1
’имическа€ термодинамика. ’имическа€ кинетика и равновесие
¬ариант 1
1. „то называетс€ внутренней энергией, энтальпией?
2. ќпределите количество теплоты, выдел€ющеес€ при гашении 100 кг извести водой при 25 ∞—, если известны стандартные теплоты образовани€ веществ, участвующих в химической реакции:
ΔfH˚298 (CaO кр) = -635,1 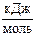 ;
;
ΔfH˚298 (Ќ2ќ ж) = -285,84 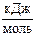 ;
;
ΔfH˚298 (Ca(OЌ)2 кр) = -982,2 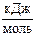 .
.
3. »сход€ из ΔfG˚298 соединений, участвующих в реакции, определите, возможна ли реакци€:
Al2O3 (кр) + 3SO3 (г) Ѓ Al2(SO4)3 (кр)
4. ¬ какую сторону сместитс€ равновесие реакции:
NiO (кр) ЂNi (кр) +  O2 (г) Ц Q; ΔrH = 262 кƒж
O2 (г) Ц Q; ΔrH = 262 кƒж
при понижении температуры, при понижении давлени€?
5. ¬о сколько раз изменитс€ константа скорости реакции при увеличении температуры от 500 до 1000 , если энерги€ активации равна 95,5 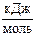 .
.
6. ¬ычислите константу равновеси€ химической реакции:
2SO2 (г) + O2 (г) Ђ2SO3 (г),
протекающей в закрытом сосуде при посто€нной температуре. Ќачальные концентрации веществ равны (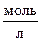 ): —(SO2) = 0,08; C(O2) = 0,06. моменту наступлени€ равновеси€ в смеси остаЄтс€ 20% первоначального количества SO2.
): —(SO2) = 0,08; C(O2) = 0,06. моменту наступлени€ равновеси€ в смеси остаЄтс€ 20% первоначального количества SO2.
онтрольна€ работа 1
’имическа€ термодинамика. ’имическа€ кинетика и равновесие
¬ариант 2
1. ¬ычислите теплоту образовани€ Fe3O4, исход€ из реакции, протекающей по уравнению:
8Al + 3Fe3O4 Ѓ 4Al2O3 + 9Fe + 3349,9 кƒж
если теплота образовани€ Al2O3 равна Ц1675 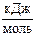 . —формулируйте закон, на основе которого решаютс€ подобные задачи.
. —формулируйте закон, на основе которого решаютс€ подобные задачи.
2. ќпределите ΔrS˚298 системы: H2 (г) + S (ромб) Ѓ H2S (г)
3. ¬ычислите ΔrG˚298 системы PbO2 + Pb Ѓ 2PbO на основании ΔfH˚298 и S˚298 реагирующих веществ. ќпределите, возможна ли эта реакци€.
4. ”кажите факторы, вли€ющие на скорость химической реакции. —формулируйте правило ¬ант-√оффа.
5. ќпределите энергию активации реакции, если при увеличении температуры от 500 до 1000 константа скорости реакции возросла в 100 раз.
6. онстанта равновеси€ химической реакции H2 (г) + I2 (г) Ѓ 2HI (г) при некоторой температуре равна 4. –ассчитайте равновесную концентрацию HI, если исходные концентрации H2 и I2 равны соответственно 0,030 и 0,012 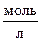 .
.
онтрольна€ работа 1
’имическа€ термодинамика. ’имическа€ кинетика и равновесие
¬ариант 3
1. ¬ каких случа€х возможно самопроизвольное протекание химических реакций при стандартных услови€х, если прин€ть ½DH∞½>>½TDS∞½?
|
|
|
2. ¬осстановление диоксида свинца водородом протекает по уравнению:
PbO2 (кр) + H2 (г) Ѓ PbO (кр) + H2O (ж); ΔrH˚298 = -182,8 кƒж
ќпределите стандартную теплоту образовани€ PbO2.
3. –ассчитайте ΔrS˚298 реакции разложени€ бертолетовой соли, если:
S˚298(KClO3) = 142,97  ,
,
S˚298(KCl) = 82,68  .
.
4. ƒаны следующие системы:
— (гр) + Ќ2ќ (г) Ђ—ќ (г) + Ќ2 (г); ΔrH = 131,4 кƒж
Ќ2 (г) + Cl2 (г) Ђ2HCl (г); ΔrH = -175,7 кƒж
–Cl5 (г) ЂPCl3 (г) + Cl2 (г) + Q
CO (г) + —l2 (г) Ђ—OCl2 (г) Ц 109,6 кƒж
”кажите, кака€ из систем (1) Ц (4) €вл€етс€ гомогенной? ƒл€ каких из реакций (1) Ц (4) равновесие сместитс€ влево при повышении температуры?
5. ¬ычислите энергию активации реакции разложени€ диоксида азота: 2NO2Ѓ 2NO + O2,
если константы скорости реакции при 600 и 640 соответственно равны 83,9 и 407,0  .
.
6. ¬о сколько раз увеличитс€ скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 ∞—, если температурный коэффициент реакции равен 2?
онтрольна€ работа 1
’имическа€ термодинамика. ’имическа€ кинетика и равновесие
¬ариант 4
1. ѕочему при низких температурах критерием, определ€ющим направление самопроизвольного процесса реакций, может служить знак DH, а при достаточно высоких температурах таким критерием €вл€етс€ знак DS?
2. ѕри растворении 16 г —аќ в воде выдел€етс€ 19,3 кƒж теплоты. ќпределите стандартную теплоту образовани€ —а(ќЌ)2.
3. ¬ычислите изменение энтропии при стандартных услови€х в следующей реакции:
—Ќ4 (г) + 4Cl2 (г) Ѓ ——l4 (ж) + 4HCl (г)
S˚298(—Cl4 ж) = 216,19  .
.
4. ¬ каких единицах выражаетс€ концентраци€ газообразных и жидких веществ (укажите размерность)?
5. онстанта скорости реакции ј + 2¬ Ѓ 3— равна 0,6  . Ќачальные концентрации ј и ¬ равны соответственно 2,0 и 2,5
. Ќачальные концентрации ј и ¬ равны соответственно 2,0 и 2,5 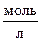 . ¬ результате реакции концентраци€ вещества ¬ оказалась равной 0,5
. ¬ результате реакции концентраци€ вещества ¬ оказалась равной 0,5 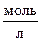 . ¬ычислите, какова концентраци€ вещества ј и начальна€ скорость реакции.
. ¬ычислите, какова концентраци€ вещества ј и начальна€ скорость реакции.
6. –ассчитайте константу равновеси€ химической реакции при 1000 , если стандартна€ энерги€ √иббса реакции равна при этой температуре Ц19,1 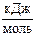 .
.
онтрольна€ работа 1






