Уравнение состояния идеального газа

Д.И.Менделеев придал этой формуле общую форму, воспользовавшись законом Авогадро. Пусть масса газа равна 1 кмоль, тогда:

Поведение реальных газов можно описать уравнением Ван-дер-Ваальса:
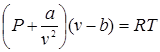 ,
,
Майер на основе опытных данных установил эквивалентность между теплотой и работой:
 , (2.1)
, (2.1)
где А – коэффициент пропорциональности.
математическим выражением первого закона термодинамики:
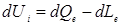 , (2.2)
, (2.2)
где U – внутренняя энергия системы.
Работу расширения и сжатия, где
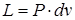 .
.
Следовательно, выражение (2.3) для одного килограмма газа примет вид:
 .
.
В изохорном процессе все подводимое тепло идет на увеличение внутренней энергии газа
 ;
;  .
.
 ;
; 
первое математическое выражение первого закона термодинамики примет вид:
 .
.
Первый закон термодинамики через энтальпию

второе математическое выражение первого закона термодинамики:
 .
.
уравнение Майера:
 .
.
На практике важное значение имеет величина показателя адиабаты К, который равен:
 . (2.16)
. (2.16)
Из молекулярно – кинетической теории газов вытекает:
- для одноатомных газов 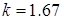 ;
;
- для двухатомных газов  ;
;
- для трех- и многоатомных газов  .
.
Для процессов протекающих при постоянном давлении установили, что  , отсюда
, отсюда
 .
.
Зная величину показателя адиабаты можно определить теплоемкости различных веществ:
 ;
;  .
.
Изменение внутренней энергии определяется по общей формуле:
 .
.
Изохорный процесс. Доля теплоты, идущей на изменение внутренней энергии:
 .
.
Изобарный процесс.Доля теплоты, идущая на изменение внутренней энергии:
 ,
,
где k – показатель адиабаты.
 уравнение изотермы:
уравнение изотермы:
; α=0
уравнение адиабаты:
 .
.
уравнение политропы:
 .
.
Теплоемкость газов в политропном процессе

1) в изохорном процессе 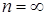 получаем, что
получаем, что
 .
.
Вычтем из обеих частей уравнения по единице, получим:
 ;
;
 .
.
2) в изобарном процессе n= 0 получаем, что
 ;
;
 .
.
3) в изотермическом процессе n= 1 получаем, что
 ;
;
 .
.
4) в адиабатном процессе n=k получаем, что
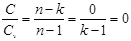 ;
;
 .
.
уравнение политропы

термического КПД:

термического КПД цикла Карно:

Степень расширения (сжатия) - это отношения большего объема к меньшему объему в процессе:
 .
.
Для оценки эффективности работы холодильных машин служит холодильный коэффициент 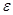 :
:
 .
.
термического КПД обратимого и необратимого циклов имеет вид:
 .
.
Термический КПД обратимый цикл

. Термический КПД обратимого цикла

Интегральная сумма приведенных теплот
 => Клаузиус назвал энтропией S
=> Клаузиус назвал энтропией S 
для обратимых и необратимых циклов общее выражение для приведенной теплоты примет вид:
 ;
;
 .
.
Для обратимого адиабатного процесса:
 , то есть
, то есть 
изменение энтропии для изотермических, изохорных процессов;

изменение энтропии для изобарных процессов
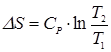
угловые коэффициенты изохоры и изобары
 ;
;  .
.
Изменение энтропии в политропном процессе можно определить по формуле:
 ;
;

значение углового коэффициента для политропных процессов:
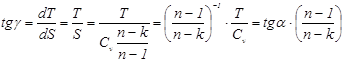 .
.
 ..
..






