Зиологическая роль АФК.
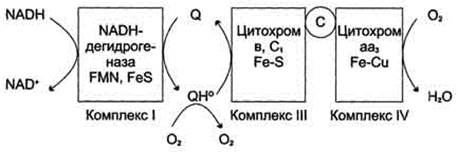
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других ОВР. Ферменты, участвующие ОВР с использованием О2, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один или два атома кислорода в образующийся продукт реакции.
эти реакции необходимы для многих специфических реакций в обмене аминокислот), синтезе жёлчных кислот и стероидов), в реакциях обезвреживания чужеродных веществ в печени
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона, которые располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
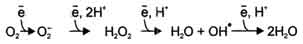
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки
Повреждающее действие свободных радикалов на компоненты клетки. 1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий;
В фагоцитирующих лейкоцитах в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов.
Билет №2
1 - (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение в кровь белкового гормона секретина. Этот гормон стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0.
Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
1. Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В.
Активация трипсиногена происходит под действием фермента энтеропептидазы.
Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов.
2. Специфичность действия протеаз
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три).
Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина.
Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Дипептидазы расщепляют дипептиды на АК.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных ак.
В. Защита клеток от действия протеаз
Клетки поджелудочной железы защищены от действия пищеварительных ферментов т.к:
эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника.
в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс.
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия.
Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки.
Желтухи
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах, закупорка желчевыводящих протоков печени.
содержание билирубина в крови повышается. При достижении определённой концентрации он диффундирует в ткани, окрашивая их в жёлтый цвет. Пожелтение тканей называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не станет выше 50 мкмоль/л.
1. Гемолитическая (надпечёночная) желтуха результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Основная причина - наследственные или приобретённые гемолитические анемии. Гипербилирубинемия у больных гемолитической желтухой обусловлена значительным повышением (103 - 171 мкмоль/л) в крови концентрации непрямой билирубин). Образование в печени и поступление в кишечник больших количеств прямого билирубина ведёт к усиленному образованию и выделению с калом и мочой уробилиногенов.
Один из главных признаков гемолитической желтухи - повышение содержания в крови непрямого билирубина.
Неконъюгированный билирубин токсичен. нарушает в митохондрии дыхание и окислительное фосфорилирование.
Желтуха новорождённых "физиологическая желтуха", наблюдающаяся в первые дни жизни ребёнка. Причина - ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина.
2. Печёночно-клеточная желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров при острых вирусных инфекциях, хроническом и токсических гепатитах.
Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые не могут переводить конъюгированный билирубин из клеток в жёлчь против градиента концентрации. В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена.
3. Механическая желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной При полной закупорке общего жёлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Кал обесцвечен. происходит утечка билирубина в кровь, в крови повышена концентрация конъюгированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет.
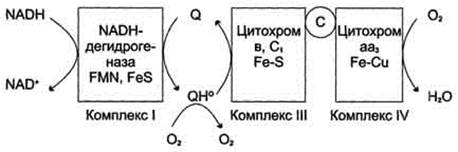
3. В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других ОВР. Ферменты, участвующие ОВР с использованием О2, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один или два атома кислорода в образующийся продукт реакции.
эти реакции необходимы для многих специфических реакций в обмене аминокислот), синтезе жёлчных кислот и стероидов), в реакциях обезвреживания чужеродных веществ в печени
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона, которые располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
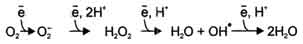
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки
Повреждающее действие свободных радикалов на компоненты клетки. 1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий;
В фагоцитирующих лейкоцитах в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов.
Все ферменты антиоксидантной системы содержат в активном центре ионы металлов с переменной валентностью, которые в зависимости от условий выступают как окислитель, так и восстановитель.
Супероксиддисмутаза катализирует реакцию дисмутации супероксидных анион – радикалов:
О2.- + О2.- = О2 + Н 2О2
Билет №3 1- Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь
Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа+,К+-АТФ-азы.
Перенос через щёточную кайму осуществляется целым рядом переносчиков,
известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
нейтральных, с короткой боковой цепью (аланин, серии, треонин);
нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);
с катионными радикалами (лизин, аргинин);
с анионными радикалами (глутаминовая и аспарагиновая кислоты);
иминокислот (пролин, оксипролин).
Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина.
Одна из специфических транспортных систем функционирует в кишечнике, почках и, мозге. Она получила название γ-глутамильного цикла
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет фермент γ -глутамилтрансфераза. катализирует перенос γ-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Реакция протекает следующим образом γ -Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза.
Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного остатка под действием фермента γ-глутамилциклотрансферазы Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ.
2- Регуляция синтеза гема Сукцинил-КоА, 2-Аминолевулиновая к-та, порфибилиноген, Гидроксиметилбилан-уропорфириноген III-копропорфириноген III-протофибрин IХ-гем
Регуляторную реакцию синтеза гема катализирует фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором синтеза аминолевулинатсинтазы является гем
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо.
Аминолевулинатдегидратаза также аллостерически ингибируется гемом,
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.






