Группа анионов
Реакции аниона SO42-.
В водных растворах диссоциация серной кислоты по первой ступени протекает полностью, по второй – частично (рКа, 2=1,92). Большинство сульфатов и гидросульфатов хорошо растворимы в воде, причем, гидросульфаты растворимы лучше. Малорастворимы сульфаты свинца, бария, стронция, кальция, серебра и ртути(I).
1. Реакция с хлоридом бария.
а) Ва2+ с сульфат-ионом образует белый кристаллический осадок, практически нерастворимый в воде (ПРВаSO4=1,1·10-10) и кислотах:
Ba2+ + SO42- = ↓BaSO4
Последним свойством BaSO4 отличается от солей бария других анионов, чем пользуются при дробном открытии SO42-. Реакции мешают S2O32- и смесь SO32- и S2-. Так как при подкислении выделяется осадок серы, который можно принять за сульфат бария, так как он тоже нерастворим в кислотах:
S2O32- + 2H+ = ↓S + SO2 + H2O
SO32- + 2S2- + 6H+ = ↓ 3S + 3H2O
Сульфат бария растворим в растворе ЭДТА.
Выполнение реакции. К нескольким каплям раствора, содержащегоSO42-, подкисленного несколькими каплями раствора НСl добавить равный объём хлорида бария. Наблюдать образование осадка.
б) В присутствии КМnO4 сульфат-ион образует изоморфные кристаллы (ВаSO4 и KMnO4) розоватого цвета. При добавлении восстановителей (Н2С2О4, Н2О2) раствор обесцвечивается, осадок остается окрашенным. Если к раствору с осадком добавить 3-5 капель эфира, осадок флотируется на границе раздела фаз. Мешают все серосодержащие анионы, так как подвергаются окислению перманганатом калия.
Выполнение реакции. К нескольким каплям подкисленного серной кислотой раствора, содержащего SO42- добавить равный объём разбавленного раствора КМnO4 (бледно-розовый цвет) и 2-3 капли раствора ВаСl2. Нагреть, добавить несколько капель 3% раствора Н2О2. Что наблюдается? Записать уравнение реакций.
Реакции аниона SO3 2-
SO32- - ион является анионом слабой сернистой кислоты /рКа,I = 1,89, рКа,2 = 7,17/. В виде молекул H2SO3 существует в растворах в очень малых количествах. В водных растворах в очень малых количествах. В водных растворах возможны следующие равновесия:
SO2 + xH2O = SO2·xH2O
SO2 + H2O = H2SO3 (Kp<<1)
SO2·xH2O = HSO3- + H3O+ + (x-2)H2O
При нагревании все равновесия смещаются влево, при кипячении можно полностью удалить SO2. При охлаждении выделяется осадок кристаллогидрата SO2·7H2O. В воде растворимы только сульфиты щелочных металлов и аммония. SO32- - ион в водных растворах постепенно окисляется до SO42-.
1. Реакция с хлоридом бария.
Барий с сульфит – ионом образует белый осадок, растворимый в кислотах:
Ba2+ + SO32- = BaSO3↓
BaSO3↓ + 2H+ == Ba2+ + H2O + SO2↑
Выполнение реакции. К 2-3 каплям раствора, содержащего SO32-, добавить 2-3 капли раствора BaCI2. Что образуется? Как действуют минеральные кислоты на осадок?
2. Реакция с минеральными кислотами.
HCI, H2SO4 и другие разлагают сульфиты с выделением SO2, который является восстановителем и обесцвечивает растворы I2 и KMnO4:
SO2 + I2 + 2H2O = SO42- + 2I- + 4H+
5SO2 + 2MnO4- + 2H2O = 5SO42- + 2Mn2+ + 4H+
Мешают анионы S2O32- и S2-. При подкислении раствора тиосульфата выделяется SO2, сульфида – Н2S, также обесцвечивающие растворы окислителей.
Выполнение реакции. К нескольким каплям сульфита натрия прибавить равный объем раствора H2SO4 и 1-2 капли раствора KMnO4. Подогреть. Что наблюдается? Вместо KMnO4 можно использовать раствор I2, к которому добавлено несколько капель крахмала.
Реакции аниона S2O32-
S2O32- ион является анионом тиосерной кислоты. Это неустойчивая кислота, в водном растворе разлагается с выделением SO2. Графически строение аниона можно представить следующим образом:
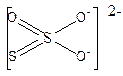
Хорошо растворимы соли щелочных металлов, стронция, цинка, кадмия, никеля, кобальта, марганца и железа(II). Малорастворимые тиосульфаты, например серебра, меди, ртути(II), бария и некоторые другие в водных растворах переходят в сульфиды.
- Реакции с хлоридом бария.
BaCl2 образует с тиосульфат-ионом белый осадок по уравнению:
Ва2+ + S2O32- = ↓Ва S2O3
заметно растворимый при нагревании. При растворении в минеральных кислотах осадок разлагается, выделяя серу.
Выполнение реакции. Получить осадок тиосульфата бария. Проверить его отношение к нагреванию, кислотам.
- Реакция с нитратом серебра.
АgNO3 образует с тиосульфат-ионом белый осадок Аg2S2O3, который постепенно переходит в сульфид серебра, при этом осадок быстро желтеет, буреет и затем становиться черным:
↓Аg2S2O3 + н2о = ↓Аg2S + Н2SO4
Нагревание ускоряет этот процесс. При действии НNО3 и нагревании происходит растворение сульфида серебра:
↓3Аg2S + 8HNO3 = 6AgNO3 + ↓3S + 2NO↑ + 4H2O
При большой концентрации S2O32- возможно образование комплексных анионов Аg S2O3-, [Аg (S2O3)2]3-, [Аg (S2O3)3]5-, в равновесии с ними могут находиться двух- и полиядерные анионы типа [Аg2(S2O3)3]4-, [Аg 6(S2O3)8]10-; поэтому не надо брать избыток S2O32- - ионов. Обнаружению тиосульфат ионов мешает S2- солями кадмия в нейтральной среде или солями свинца в уксуснокислой среде.
Выполнение реакции. Приготовить раствор Nа2S2O3 в пробирке из нескольких кристалликов вещества и примерно 1мл воды, добавить 3-5 капель раствора AgNO3, нагреть, перемешать. Наблюдать изменение цвета. Записать уравнения реакций.
3. Реакция с минеральными кислотами.
Кислоты разлагают тиосульфаты с выделением тиосерной кислоты по уравнению:
S2O32- + 2H+ = H2S2O3
H2S2O3 = H2O + ↓3S + SO2↑
Этой реакции мешает сочетание ионов SO32- S2-, так как при подкислении происходит их взаимодействие:
H2S2O3 = H2O + ↓S + 3H2O
Выполнение реакции. К нескольким каплям раствора, содержащего S2O32- -ионов до тетратионат-ионов по уравнению:
2S2O32- + I2 = S4O62- + 2I-
В щелочном растворе йод диспропорционирует на йодид и йодноватистую кислоту:
I2 + OH- = I- + HIO
HIO окисляет S2O32- до SO42-:
4HIO + S2O32- + 6OH- = 4I- + 2SO42- + 5H2O
Обнаружению мешают SO32- и S2-.
Выполнение реакции. К 3-5 каплям раствора йода добавить 1 каплю крахмала, 5-7 капель раствора тиосульфата натрия. Что наблюдается?
Реакции аниона СО32-.
Соответствующая карбонат-иону угольная кислота является очень слабой кислотой (рКа,1=6,35, рКа,2=10,30) и существует только в водном растворе. Насыщенный водный раствор при18 0С и атмосферном давлении является примерно 0,04М относительно СО2. В водном растворе имеют место следующие равновесия:
Н2О + СО2 = Н2СО3 = Н+ + НСО3- = 2Н+ + СО32-
Из солей в воде растворимы карбонаты щелочных металлов и аммония (за исключением LiCO3) и гидрокарбонаты щелочных и щелочноземельных металлов. Малорастворимые соли легко растворяются в уксусной и минеральных кислотах. Соли угольной кислоты сильно гидролизуются и их водные растворы имеют щелочную реакцию.
1. Реакция с хлоридом бария.
ВаСl2 с растворимыми карбонатами образует на холоду белый аморфный осадок карбоната бария, который постепенно при стоянии переходит в кристаллическую форму.
Выполнение реакции. Получить осадок карбоната бария, разделить на две пробирки и испытать действие растворов уксусной и соляной кислот. Записать уравнение реакций.
2. Реакция с кислотами.
Кислоты, в том числе и СН3СООН, разлагают карбонаты с выделением СО2:
2Н+ + СО32- = Н2О + СО2↑,
Который обнаруживают по помутнению известковой или баритовой воды.
СО2 + Са(ОН)2 = ↓СаСО3 + Н2О
СО2 + Ва(ОН)2 = ↓ВаСО3 + Н2О
При длительном пропусконии углекислого газа осадок растворяется:
↓СаСО3 + СО2 + Н2О =Са2+ + 2НСО3-
Обнаружению мешают ионы SO32- и S2O32-, так как SO2, образующийся при подкислении раствора, также образует белые осадки Са SO3 и Ва SO3. Поэтому перед открытием карбонат-иона надо предварительно окислить SO32- и S2O32- до SO42- пероксидом водорода при нагревании в течение 2-3 минут.
Выполнение реакции. В пробирку с 1 мл раствора BaCO3 внести равный объём раствора НСl. Закрыть газоотводной трубкой и выделяющийся при нагревании СО2 пропускать в раствор известковой воды. Что наблюдается? Продолжить пропускать СО2. Описать наблюдаемые явления.
Реакции аниона РО4 3-
РО43- - анион является анионом трёхосновной фосфорной кислоты (рКа,1=2,15, рКа,2=7,21, рКа,3 = 12,33). То есть, по первой ступени диссоциации это кислота средней силы, по второй и третьей – слабая. В воде растворимы все фосфаты щелочных металлов (кроме Li3РО43-) и аммония, а также дигидрофосфаты щелочных и щелочноземельных металлов. Малорастворимые в воде фосфаты растворяются в минеральных кислотах.
1. Реакция с хлоридом бария.
Ва2+ образует с анионом РО43- белый осадок, растворимый в уксусной и минеральных кислотах (кроме Н2SO4):
Ва2+ + НРО42- = ↓ВаНРО4
Выполнение реакции. Получить осадок ВаНРО4, проверить его растворимость в кислотах и записать уравнение реакций.
2. Реакция с нитратом серебра.
AgNO3 с анионами РО43- желтый осадок фосфата серебра, растворимый в соляной кислоте и аммиаке:
3 Ag+ + РО43- = ↓ Ag3РО4
Выполнение реакции. Получить осадок фосфата серебра, проверить его растворимость и записать уравнение реакций.
3. Реакция с магнезиальной смесью.
Магнезиальная смесь (MgCl2 + NH4Cl + NH3 в растворе) образует с фосфат-ионом белый кристаллический осадок двойной соли, растворимый в СН3СООН и НСl:
Mg2+ + НРО42- + NH3 = ↓ Mg NH4 РО4
↓ Mg NH4 РО4 + 3Н+ = Mg2+ + NH4+ + Н3РО4
↓ Mg NH4 РО4 + 2СН3СООН = Mg2+ + 2СН3СОО- + Н2РО4- + NH4+
Выполнение реакции. К нескольким каплям раствора, содержащего РО43-, добавить 1,5-кратный избыток раствора магнезиальной смеси, перемешать. Наблюдать образование осадка. Описать его внешний вид и проверить отношение к растворам СН3СООН, НСl, NH3.
4. Реакция с молибденовой жидкостью.
Молибденовая жидкость (раствор (NH4)2MoO4 в НNO3 (образует с РО43- - ионом желтый кристаллический осадок 12-молибдофосфата аммония:
3NH4+ + РО43- + 12MoO42- + 24H+ = ↓(NH4)3Р(Мо3О10)4 + 12Н2О
Осадок растворим в избытке в избытке фосфата, в щелочах и в растворе аммиака:
↓(NH4)3Р(Мо3О10)4 + 24 NH3 + 12Н2О = (NH4)3РО4 + 12(NH4)2MoO4
Обнаружению мешают ионы-восстанвители: SO32-, S2O32-, S2-, избыток Сl-, т.к. они восстанавливают Р(Мо3О10)43- до молибденовой сини (соединения молибдена низших степеней окисления). Поэтому перед обнаружением РО43- проводят окисление примесей 6М НNO3 при кипячении. SiO32- в тех же условиях образует 12-молибдосиликат (NH4)4Si(Mo3O10)4 желтого цвета, который в отличие от 12-молибдофосфата аммония растворим в НNO3.
Выполнение реакции. К 2-3 каплям раствора, содержащего РО43-, прибавить 5-7 капель молибденовой жидкости, нагреть. Что наблюдается? Проверить растворимость осадка в растворах кислот, щелочей, аммиака.
Реакции аниона SiО32-
Свободная кремневая кислота почти нерастворима в воде, но легко образует коллоидные растворы, при разрушении которых осаждается гель n SiO2∙mH2O (n и m зависят от русловий осаждения). Известны метакремниевая Н2SiО3, двуметакремневая Н2Si2О5 и ортокремневая Н4SiО4 кислоты. Основной формой существования кислоты в растворе является очень слабая Н4SiO4. Известны поликремневые кислоты. Растворимы в воде только силикаты щелочных металлов. Водные растворы их имеют сильнощелочную реакцию вследствие гидролиза.
1. Реакция с хлоридом бария.
ВаCl2 c анионами SiО32- образует белый осадок силиката бария.
Ва2+ + SiО32- = ↓ВаSiО3
Выполнение реакции. Получить осадок ВаSiО3 и проверить его растворимость в слабых (СН3СООН) и сильных (НСl) кислотах.
2. Реакция с разбавленными кислотами.
2mH+ + nSiO32- == ↓nsiO2∙mН2О
Растворы кислот при медленном добавлении к SiО32- образуют белый студенистый осадок (гель) кремневых кислот nsiO2∙mН2О.
Выполнение реакции. К нескольким каплям раствора, содержащего SiО32-, добавить по каплям 2м НСl. Что наблюдается?
3. Реакция с солями аммония.
Соли аммония выделяют из растворов силикатов кремневую кислоту полнее, чем кислоты:
SiO32- + 2H2O = Н2SiО3 + 2OH-
NH4+ + 2H2O = 2NH3 + 2H3O+
SiO32- + NH4+ = 2NH3 + ↓Н2SiО3
Образование силиката аммония не происходит вследствие его полного гидролиза. Этой реакцией можно обнаружить SiO32- в присутсвии. Если на холоду осадок не выпадает, раствор нагревают несколько минут на водяной бане.
Выполнение реакции. К 4-5 каплям раствора, содержащего SiO32-, прибавить 3 капли раствора NH4Cl, нагреть. Что наблюдается?
Реакции борат-ионов
Борная кислота Н3ВО3 является очень слабой кислотой, диссоциирует только по 1 ступени (рКа= 9,24). В растворе устанавливается равновесие:
B(OH)3 + H2O = B(OH)4- + H+
При больших концентрациях Н3ВО3 кислотность увеличивается вследстие образования полимерных частиц и константа повышается (рКа=6,48):
3В(ОН)3 = В3О3(ОН)4- + Н+ + 2Н2О
Силу борной кислоты можно увеличить добавлением полиоксисоединений (глицерин, маннит); тогда образуются хелаты – циклические эфиры ортоборной кислоты:

Существуют соли состава КВ5О8∙4Н2О, Na2В4О7, СаВ2О4 и другие. Анионы безводных боратов представляют собой циклические или линейные полимеры из группы ВО3 и ВО4. Например, анион В2О4 2- - анион бесконечной цепи.

Гидратированные бораты, например, Na2B4O7·10H2O, содержат в кристалле полиионы, не все могут существовать в растворе. B4O72- взаимодействует с водой
B4O72- + 5Н2О = 2Н3ВО3 + 2Н2ВО3-
Растворимы в воде только бораты щелочных металлов. Нерастворимые в воде бораты не растворимы в кислотах.
1. Окрашивание пламени.
Летучие соединения бора (Н3ВО3, ВF3; эфиры Н3ВО3) окрашивают пламя горелки в зеленый цвет.
Большинство боратов разлагаются концентрированной Н2SO4 с выделением летучей Н3ВО3. Обнаружению мешают соли бария, меди, а также фосфаты и молибдаты. В присутствии РО43- образуется метафосфат борила (ВО)РО3, термически устойчивое нелетучее соединение; молибдаты образуют нелетучий 12- молибдоборат.
Выполнение реакции. Выпарить в фарфоровой чашке несколько капель раствора, содержащего борат-ионы. Сухой остаток смочить 1-2 каплями (не более) Н2SO4 концентрированной, добавить несколько капель этанола или метанола, хорошо перемешать, стеклянной палочкой и поджечь. Наблюдать окрашивание пламени по краям в зеленый цвет.
II Группа анионов
Реакции аниона Сl-
Хлорид-ион является анионом соляной кислоты НСl. В водных растворах НСl полностью диссоциирует:
НСl + Н2О = Н3О+ + Сl-
Большинство хлоридов хорошо растворимы в воде. Малорастворимыми являются хлориды II группы катионов; основные хлориды сурьмы, висмута и олова.
1. Реакция с нитратом серебра.
AgNO3 образует с хлорид-ионом белый творожистый осадок, нерастворимый в НNO3:
Ag+ + Cl- = ↓AgCl
на свету осадок темнеет вследствие разложения и выделения элементарного серебра:
2AgCl = 2 Ag + Сl2↑
AgCl легко растворяется в растворах веществ, способных связывать Ag+ в устойчивый комплекс (NH3, (NH4)2CO3, KCN, Na2S2O3):
↓AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
↓AgCl + 2NH4+ + 2CO32- = [Ag(NH3)2]+ + Cl- + 2 HCO3-
↓AgCl + 2CN- = [Ag(CN)2]- + Cl-
↓AgCl + 2S2O32- == [Ag(S2O3)2]3- + Cl-
Для подкисления раствора, содержащего [Ag(NH3)2]+ раствором азотной кислоты снова выпадает AgCl:
[Ag(NH3)2]+ + Cl- + 2H+ = ↓AgCl + 2NH4+
Выполнение реакции. К нескольким каплям раствора, содержащего Сl- добавить медленно по каплям раствор AgNO3. Что наблюдается? Проверить его растворимость в растворах NH3 и (NH4)2CO3. Разрушить комплекс действием раствора НNO3.
Осадки AgSCN, AgBr и AgI в отличие от AgCl практически не растворимы в карбонате аммония, этим пользуются для разделения анионов. В присутствии больших количеств Br-, I- и NCS- определение можно провести следующим образом. В слабо азотно- или уксуснокислых растворах Br- и I- окисляются пероксидом водорода до свободного состояния. Если в растворе присутствует 8-оксихинолин, он бромируется или йодируется:

В кислых растворах полученный 5,7-дийодид-8-оксихинолин не реагирует с AgNO3.
Тиоционат-ион окисляется пероксидом водорода до SO42- или (NCS)2 и также не мешает. Обнаружение Сl- можно считать специфифичным.
Выполнение реакции. В пробирку вносят каплю исследуемого раствора, каплю 2% 8-оксихинолина в уксусной кислоте (1:4), 1 каплю 4% Н2О2 в 2М СН3СООН и каплю 2М СН3СООН и каплю 2М НNO3. Затем добавляют каплю раствора AgNO3. Появляется осадок или AgCl.
2. Реакция с окислителями.
Е0Сl2/2Cl- = 1,36в., то-есть Сl- -ионы являются слабыми восстановителями. При действии сильных окислителей (КMnO4, РbO2, KClO3) в кислой среде происходит выделение свободного хлора, который можно обнаружить по запаху, по посинению бумаги, смоченной раствором КI и крохмальнім клейстером:
2Сl- + МnO2 + 4H+ = Cl2↑ + Mn2+ + 2H2O
Cl2 + 2I- = I2 + 2Cl-
Мешают I- и Br- -ионы.
Выполнение реакции. В пробирку с несколькими каплями раствора, содержащего Сl- -ионы, добавить шпатель сухого МnO2 и раствора Н2SO4. Нагреть (тяга!). Доказать выделение Сl2 Соответствующими реакциями.
Реакции иона Вr-
Бромистоводородная кислота НВr, как и соляная, в водных растворах является сильной кислотой. Малорастворимы бромиды катионов II группы. Вr- - ион может образовывать бромидные комплексы, например, AgBr43-, HgBr42-.
1. Реакция с нитратом серебра.
AgNO3 образует с Br-ионом бледно-желтый осадок, нерастворимый в НNO3 , (NH4)2CO3, малорастворимый в NH3:
Ag+ + Вr- = ↓AgBr
AgBr хорошо растворяется в КСN, Na2S2O3 c образованием соответствующих комплексних соединений.
Выполнение реакции. К нескольким каплям раствора, содержащего Вr- добавить равный объём раствора AgNO3. Наблюдается образование осадка. Изучить его отношение к растворам (NH4)2CO3, Na2S2O3.
2. Реакция с хлорной водой.
Хлорная вода, представляющая насыщенный раствор хлора в воде (при 250С образуется 0,091М Сl) окисляет бромид-ионы свободного брома:
2Вr- + Cl2 = Br2 + 2Cl-
Свободный бром хорошо растворяется в органических растворителях (С6Н6, СНCl3, CCl4), потому, если к исследуемому раствору добавить один из растворителей, который не смешивается с водой, затем хлорную воду и хорошо перемешать, после расслаивания органический слой, содержащий свободный бром, окрашивается в оранжевый цвет.
При избытке хлорной воды бурая окраска исчезает, т.к. Вr2 окисляется до BrCl2:
Br2 + Cl2 = 2BrCl
Обнаружению Вr- мешают сильные восстановители SO32-, S2O32-, S2-. Поэтому при решении аналитических задач Br- открывают в осадке анионов II группы.
Выполнение реакции. К нескольким каплям раствора, содержащего Вr-, прибавить несколько капель раствора Н2SO4 и I2 и Н2О. Раствор буреет. Экстрагировать выделившийся бром добавлением нескольких капель органического растворителя. Хорошо встряхнуть. Что наблюдается?
3. Реакция с фуксином.
Органический краситель фуксин образует с NaHSO3 бесцветный продукт присоединения. Если на него подействовать свободным бромом, образуется бромзамещенный краситель, окрашенный в синий цвет. Поскольку Сl2 или I2 не вызывают окрашивания, реакция дает возможность обнаружить даже очень малые количества Br- в присутствии Cl- и I-.
Выполнение реакции. В пробирку поместить 3-4 капли исследуемого раствора, 2-3 капли раствора КмnO4 и 2-3 капли раствора 2N H2SO4 для получения свободного хлора. Пробирку закрыть пробкой, в которую вставлена пипетка с капилляром, заполненным обесцвеченным раствором фуксина. Слегка подогреть содержимое пробирки. В присутствии брома обесцвеченный фуксин окрашивается в синий цвет.
Реакции аниона I-
В водных растворах йодистоводородная кислота также диссоциирует нацело. Малорастворимы в воде AgI, PbI2, Hg2I2, BiI3, CuI. Йодид-ион входит в состав комплексных солей, например, HgI42-, CdI42- и других.
1. Реакция с нитратом серебра.
AgNO3 образует желтый осадок AgI, нерастворимый в растворах HNO3 и NH3, (NH4)2CO3, но хорошо растворимый в КСN Na2S2O3.
Выполнение реакции. К нескольких каплям раствора, содержащего I- - ионы, добавить несколько капель раствора AgNO3. Проверить растворимость осадка в растворах НNO3, Na2S2O3, NH3.
2. Реакция с хлорной водой.
Водный раствор Сl2 окисляет I- до свободного йода:
Cl2 + 2I- = 2Cl- + I2
Органические растворители (CHCl3, CCl4, C6H6) экстрагируют I2, окрашиваясь в розово-фиолетовый цвет.
При дальнейшем добавлении хлорной воды окраска исчезает, т.к. I2 окисляется до иодат-иона:
5Cl2 + I2 + 6H2O = 2IO3- + 10Cl- + 12H+
При совместном присутствии Br- и I- в растворе добавление хлорной воды вызывает выделение сначала йода, при этом слой органического растворителя окрашивается в розово-фиолетовый цвет, затем обесцвечивается, появляется оранжевая окраска брома. Подобно хлорной воде на йодиды действуют и другие окислители, например Br2, H2O2, K2Cr2O7, KMnO4 в кислих и щелочных средах, соли Fe(III) и так далее.
Обнаружению йодид-ионов мешают анионы-востановители: SO32-, S2O32-, S2-. Поэтому I-, добавить 2-3 капли раствора H2SO4, несколько капель бензола и хлорной воды. Хорошо встряхнуть. Наблюдать окрашивание слоя бензола. Смешать в другой пробирке по несколько капель растворов, содержащих Br- и I-, Обнаружить анионы при совместном присутствии.
3. Реакция с нитрит-ионом.
NO2- - ион в кислой среде (H2SO4, HCl или CH3COOH) окисляет йодид-ион до I2:
2I- + 2NO2- + 4H+ = I2 + 2NO↑ + 2H2O
Образующийся I2 выпадает в виде темно-серого осадка или окрашивает раствор в бурый цвет. Обнаружить свободный йод можно с помощью раствора крахмала или извлечением его бензолом.
Br- не вступает в реакцию c NO2- - ионом. Обнаружению мешают ионы-восстановители: SO32-, S2O32-, S2-.
Выполнение реакции. К нескольким каплям раствора KI добавляют равные объёмы растворов H2SO4 и KNO2, бензол и хорошо встряхивают. Что наблюдается? Вместо бензола можно добавить 1-2 капли раствора крахмала.
Реакции аниона S2-
Насыщенный водный раствор сероводорода содержит при 180С 0,1М Н2S. Сероводородная кислота является одной из самых слабых кислот (рКа,1=7,00; рКа,2=12,89). В воде растворимы только сульфиды I и III групп катионов и магния.
1. Реакция с нитратом серебра.
AgNO3 с сульфид-ионом образует черный осадок сульфида серебра:
2Ag+ + S2- = ↓Ag2S
Этой реакцией можно открыть S2- в присутствии других анионов. Ag2S нерастворим в растворах NH3, Na2S2O3 и KCN, но растворим при нагревании в растворе HNO3:
↓3Ag2S + 8HNO3 = 6AgNO3 + ↓3S + 2NO↑ + 4H2O
Выполнение реакции. Получить осадок Ag2S нерастворим в растворах NH3, Na2S2O3 и HNO3 (при нагревании).
2. Реакция с разбавленными кислотами (НСl, H2SO4).
Разбавленные кислоты НСl, H2SO4 разлагают многие сульфиды с образованием газообразного Н2S (тяга!):
S2- + 2H+ = H2S↑
Выделение сероводорода можно обнаружить по характерному запаху или по почернению фильтровальной бумаги, смоченной раствором ацетата свинца или его гидроксикомплекса. При испытании соли Сd2+, бумага окрашивается в оранжевый цвет:
H2S + Pb(CH3COO)2 = ↓PbS + 2CH3COOH
H2S + [Pb(OH)4]2- = ↓PbS + 2OH- + 2H2O
H2S + Cd2+ = ↓CdS + 2H+
Выполнение реакции. В пробирку 5-10 каплями раствора соли, содержащей S2- добавить равный объём раствора НСl или H2SO4, подогреть и в парвх подержать полоску фильтровальной бумаги, смоченной Pb(CH3COO)2 или [Pb(OH)4]2-. Что наблюдается? Записать уравнение протекающих реакций. Повторить опыт, используя для определения S2- -аниона раствор соли кадмия.
3. Реакции восстановления, производные S2-.
Вследствие малой величины стандартного потенциала (Е0s0/s2-= -0,48B) сульфид-ион является энергичным восстановителем. Подобно SO32- и S2O32- он восстанавливает раствор йода, перманганата калия в кислой и щелочной средах, Fe (III) и так далее.
Выполнение реакции. В пробирку с несколькими каплями раствора йода добавить равный объём раствора соли, содержащей S2-. Что наблюдается? Записать уравнение реакции.
Реакции аниона NCS-
Тиоциановая кислота НNCS – сильная кислота. Она и её производные существуют в двух формах: R-S-C≡N и R-N=C=S. По свойствам тиоционат-ион сходен с галогенидами. Большинство солей хорошо растворимы в воде, малорастворимыми являются соли катионов II группы (кроме Pb2+) NCS- -анион является комплексообразователем, например, [Co(NCS)4]2-, [Fe(NCS)6]3-.
1. Реакция с нитратом серебра.
AgNO3 образует с тиоционат-ионом белый осадок, нерастворимый в разбавленной HNO3, (NH4)2CO3, слабо растворимый в NH3:
Ag+ + SCN- = ↓AgSCN
Выполнение реакции. Смешать в пробирке равные объёмы растворов солей, содержащих ионы Ag+ и NCS-. Что наблюдается? Записать происходящие уравнения реакций.
2. Реакция с солями железа (III).
Fe(III) образует с тиоционат-ионом комплексы темно-красного цвета, где n=1-6, которые хорошо экстрагируются органическими растворителями (амиловый спирт, диэтиловый эфир). Мешают щавелевая, винная, лимонная кислоты, анилны РО43- и F-, так как связывают Fе3+ в устойчивые комплексы. Мешают СН3СОО-, так как образуют с Fе3+ ацеататный комплекс красного цвета и I-, который окисляет Fе3+ до свободного йода. При анализе смеси анион NCS- обнаруживают после определения 2 группы, из осадка.
Выполнение реакции. К 2-3 каплям раствора, содержащего NCS-, прибавить 2-3 капли раствора Н2SO4 и такой же объём раствора Fе3+. Что появляется? Проверить экстрагирующее действие амилового спирта или эфира.
III группа анионов
Реакции аниона NO3 -
Нитрат-ион является анионом сильной кислоты. В 0,1М растворе она диссоциирована на 93%. В тоже время НNO3 является довольно сильным окислителем и применяется в анализе для растворения многих металлов и сплавов. Все нитраты, кроме основных нитратов висмута и ртути, хорошо растворимы в воде.
1. Реакция с медью и серной кислотой.
При взаимодействии NO3- в сернокислой среде с металлической медью происходит окисление меди и выделение диоксида азота по уравнениям:
2NO3- + 8Н+ + 3Сu = 3Cu2+ + 2NO↑ + 4H2O
2NO↑ + O2 = 2NO2↑
Выполнение реакции. К нескольким каплям раствора NaNO3 или КNO3 прибавить равный объём концентрированной Н2SO4 и кусочек металлической меди. Содержимое аккуратно нагреть. (Тяга!). Что выделяется? Наблюдать лучше, поместив сзади пробирки лист белой бумаги.
2. Реакция с сульфатом железа (II).
FeSO4 в присутсвии концентрированной Н2SO4 восстанавливает NO3- до NO, который с избытком ионов Fe2+ образует комплексное соединение Fe(H2O)5NO2+ бурого цвета:
6 Fe2+ + 2HNO3 + 6H+ = 6 Fе3+ + 2NO + 4H2O
Fe(H2O)6NO2+ + NO = Fe(H2O)5NO2+ + H2O
Установлено, что в этом комплексе железо находится в степени окисления +1, а лигандом является ион нитрозония NO+. Коричневая окраска обусловлена полосой переноса заряда в системе Fe-N-O.
Обнаружению NO3- мешают анионы NO2-, так как дают такую же реакцию с Fe2+ в концентрированной Н2SO4; I- и Br-, которые окисляются концентрированной Н2SO4 до свободного состояния.
NCS-, дающий красный цвет, анионы-окислители IO3-, ClO3-; анионы восстановители SO32-, S2O32-, S2-. Этой реакцией можно обнаружить NO3- после осаждения ионов 1 и2 группы в отсутсвии NO2- и ClO3-.
Выполнение реакции. На стеклянную пластинку поместить каплю раствора, содержащего NO3- - анионы, кристаллик FeSO4 и осторожно каплю концентрированной Н2SO4. Наблюдать вокруг кристаллика бурое кольцо.
3. Реакция с металлическим алюминием.
В сильнощелочной среде металлический Аl восстанавливает NO3- до NH3, который можно обнаружить по изменению окраски индикаторной бумаги:
3NO3- + 8 Аl + 5OH- + 18H2O = NH3 + 8[Al(OH)4]-
Обнаружению NO3- мешают все азот-содержащие ионы (NH4+, NO2-, NCS-).
Выполнение реакции. К 3-4 каплям раствора, содержащего NO3-, прибавить 8-10 капель раствора NaOH, 1-2 гранулы металлического алюминия. Пробирку закрыть не очень плотно ватой, поверх которой поместить влажную красную лакмусовую бумажку, нагреть на водяной бане. Что наблюдается?
4. Реакция с дифениламином.
(С6Н5)2NH окисляется азотной кислотой вначале в бесцветный N,N- дифенилбензидин 1, затем в дифенилбензидин фиолетовый состава:
Обнаружению NO3—иона мешают другие ионы-окислители: NO2-, ClO3-, IO3-, Fe3+, Sb(V), CrO42-, MnO4- и т.д.
Выполнение реакции. На стеклянную пластинку или часовое стекло поместить 2-3 капли раствора дифениламина в концентрированной Н2SO4 и 1-2 капли NO3- -иона. Что наблюдается?
5. Реакция с нитроном.
Органическое основание нитрон образует с NO3- в кислой среде характерные иглообразованные кристаллы (пучки тонких игл) нитрата нитрона С20Н16N4·HNO3. Мешают NO2-, NCS-, ClO3-, I-, дающие также кристаллические осадки, но другой формы.
Выполнение реакции. На предметное стекло нанести каплю исследуемого раствора и каплю раствора нитрона в 5% растворе СН3СООН. Рассмотреть кристаллы под микроскопом.
Реакции аниона NO2 -
Нитрид-анион является анионом слабой кислоты (рКНNO2=3,21) Для азотистой кислоты возможны две структуры, которые могут переходить одна в другую:
Нитриты активных металлов построены, по-видимому, в соответствии со структурой 1, малоактивных -2.
Так, установлено, что AgNO2 существует в виде двух форм: AgONO и AgNO2. Все нитриты хорошо растворимы в воде. Наименее растворим нитрит серебра (ПРа AgNO2=2,5∙10-4), при нагревании его растворимость повышается. Малорастворимы некоторые комплексные соли, содержащие в качестве лигандов группы NO2 (К2Na[Co(NO2)6]).
Все описанные выше реакции NO3- (кроме последней) характерны и для NO2-. Отличить NO2-. Отличить NO2- от NO3- можно при помощи следующих реакций:
1. Реакция с йодидом калия.
КI в кислой среде окисляется нитритом до свободного йода:
2NO2- + 2I- + 4H+ = I2 + 2NO + 2H2O
Обнаружению мешают анионы-окислители (ClO3-, CrO4-, MnO4-, NO3-) и сильные восстановители (SO32-, S2O32-, S2-). При анализе смеси анионов NO2- обнаруживают после осаждения анионов 1 и 2 группы и в отсутствие ClO3-. Реакцию можно проводить капельным и пробирочным методами.
Выполнение реакции.
а) К нескольким каплям раствора КNO2 добавить СН3СООН и КI. Что наблюдается? Добавить 1-2 капли крахмала, наблюдать изменение цвета.
б) На полоску фильтровальной бумаги нанести последовательно каплю раствора крахмала, СН3СООН и КI. Капля должна оставаться бесцветной. Внести каплю раствора с NO2—ионом. Что наблюдается?
2. Реакция с перманганатом калия.
КMnO4 в сернокислой среде окисляет NO2- до NO3-:
5NO2- + 2MnO4- + 6Н+ = 5 NO3- + 2Mn2+ + 3H2O
Раствор КMnO4 обесцвечивается. Мешают другие ионы-восстановители (SO32-, S2O32-, S2-, NCS-, I-, Br-) и большие количества Сl-. Этой реакцией обнаруживают NO2-, слегка подогреть. Что наблюдается? Разобрать окислительно-восстановительную реакцию методом полуреакций.
3. Реакция с кислотами.
Минеральные кислоты разлагают нитриты с выделением бурого газа NO2:
2 NO2- + 2Н+ = НNO2
2НNO2 = NO2↑ + NO↑ + H2O
Выполнение реакции. К нескольким каплям раствора, содержащего NO2- добавить раствор НСl или Н2SO4. Что наблюдается? Работу выполнять под тягой!
4. Реакция с бензидином и 8-оксихинолином.
Бензидин и 8-оксихинолином в уксуснокислой среде (рН≈3) с нитрит-ионом дают ярко-красное окрашивание или осадок. Бензидин диазотируется азотистой кислотой, а образовавшийся диазоний сочетается с 8-оксихинолином и образуется азокраситель красного цвета:
Мешает только I-, так как при рН≤3 окисляется NO2—ионом до I2. При этом раствор буреет.
Выполнение реакции. К капле уксуснокислого раствора бензидина прибавить каплю раствора, содержащего NO2-, раствор СН3СООН до рН=3, несколько капель спиртового или уксуснокислого раствора 8-оксихинолина и несколько капельраствора СН3СООNa до рН 5-7. Что наблюдается?
Реакции аниона СН3СОО-
Уксусная кислота является слабой (рКа= 4,75). Почти все ацетаты хорошо растворимы в воде, кроме AgCH3COO (ПР=2,0·10-3) и Hg(CH3COO)2 (ПР=3,0∙10-15). Малорастворимы основные ацетаты, например, Fe3O(CH3COO)6OH.
1. Взаимодействие с минеральными кислотами.
Н2SO4 и другие сильные кислоты при действии на ацетаты вытесняют свободную СН3СООН, которая может быть обнаружена по запаху:
СН3СОО- + Н+ = СН3СООН
Та же реакция происходит при растирании твердого ацетата с твердыми гидросульфатами натрия или калия:
СН3СОО- + НSO4- = СН3СООН + SO42-
Обнаружению СН3СОО- мешают большие количества Сl-, Br-, I-, SO32-, S2O32-, Которые образуют НСl, Br2, I2 или SO2, имеющие острый запах. В таком случае ацетат-ион обнаруживают после осаждения этих анионов групповыми реагентами.
Выполнение реакции. К исследуемому раствору добавить равный объём раствора Н2SO4, подогреть. Что наблюдается?
2. Реакция с хлоридом железа (III).
FeCl3 образует с ацетат-ионом в нейтральной среде растворимое в воде комплексное соединение красно-бурого цвета Fe3(OH)2(CH3COO)6+, которое при разбавлении водой и нагревании водой и нагревании разрушается с образованием осадка основного ацетата Fe3O(CH3COO)6OH.
Обнаружению CH3COO- мешают анионы, которые дают с Fe3+ малорастворимые соединения – CO32-, PO43-, S2- и другие.
При анализе смеси анионов ацетат-ион обнаруживают в растворе после осаждения и отделения аниона 1 и 2 групп.
Выполнение реакции. К 3-4 каплям раствора, содержащего ацетат-ионы, прибавить 4-6 капель раствора FeCl3. Что наблюдается?
3. Реакция с этанолом.
С2Н5ОН в присутствии концентрированной Н2SO4 образует с СН3СООН уксусноэтиловый эфир, обладающий характерным приятным запахом:
СН3СООН + С2Н5ОН = CH3COOC2H5 + H2O
Обнаружению мешают Г - -анионы, SO32-, S2O32-, S2-, т.к. при действии концентрированной Н2SO4 выделяются газы с резким запахом. При анализе смеси ацетат – ион обнаруживают после отделения I – II групп анионов.
Выполнение реакции. К нескольким каплям раствора, содержащего ацетат-ионы, прибавить по 3-4 капли этанола и концентрированной Н2SO4, нагреть. Затем вылить содержимое пробирки в стакан с холодной водой. Определить образование эфира по запаху.
Ход анализа смеси анионов I-III групп
Как и при анализе катионов, анализу смеси анионов предшествуют предварительные испытания, помогающие при интерпретации результатов и выборе рациональной схемы разделения и открытия анионов. Большинство анионов можно обнаружитьв отдельных порциях анализируемого раствора дробным методом. Обнаружению анионов не мешают катионы I аналитической группы. Если в равтворе присутствуют катионы других групп, их осаждают кипячением с карбонатом натрия.
Предварительные испытания
1. Определение рН раствора.
а) Если среда кислая (рН≤2), то в исследуемом растворе не могут присутствовать анионы летучих и неустойчивых кислот: СО32-, S2О32-, NO2-, S2-. Кроме того, в кислой среде не могут присутствовать следующие пары анионов: I- и NO2-, NCS- и IO3-, I- и ClO3-, NO2- и ClO3-.
б) Если среда раствора щелочная, то в нем могут присутсвовать все рассматриваемые ионы (кроме пары IO3-и S2-).
2. Проба на присутствие анионов I группы.
К 4-5 каплям анализируемого раствора при рН 7-9 добавить равный объём раствора ВаСl2. Образование осадка указывает на наличие анионов I группы.
3. Проба на присутствие анионов II группы.
К 4-5 каплям анализируемого раствора добавить равный объём раствора AgNO3 и HNO3. В присутствии анионов II группы образуется осадок. Обратить внимание на его цвет и сделать предположительные выводы.
4. Проба на совместное присутствие некоторых окислителей и восстановителей.
а) К нескольким каплям исходного раствора добавить раствор СН3СООН до кислой среды. При совместном присутствии NO2- и I- раствор становится красно-бурым из-за выделившегося йода. Проверить добавлением раствора крахмала.
б) Подкислить другую пробу раствором соляной кислоты. Выделение йода указывает на одновременное присутствие I- и ClO3-. При наличии S2О32- или смеси SO32-и S2- раствор постепенно мутнеет.
5. Проба на присутствие анионов-восстановителей.
К нескольким каплям исследуемого раствора добавить 1-2 капли раствора NaOH и 1-2 капли разбавленного раствора KMnO4. Нагреть. Выпадение бурого осадка указывает на присутствие SO32-, S2О32-, I- или NCS-. Если анионы восстановители обнаружены, к другой порции раствора, подкисленного раствором H2SO4 добавить 2-3 капли раствора йода. В присутствии SO32- и S2О32- происходит обесцвечивание раствора.
6. Проба на присутствие анионов-окислителей.
К 4-5 каплям исходного раствора добавить раствор серной кислоты до кислой среды, несколько капель бензола или хлороформа и 1-2 капли раствора КI. Хорошо встряхнуть смесь. В присутствии анионов-окислителей (ClO3-, NO2-, NO3- и других) органический слой окрашивается в розово-фиолетовый цвет.
При одновременном присутствии окислителей и восстановителей нальзя делать окончательные выводы об отсутствии тех или иных анионов на основании отрицательного результата предварительных испытаний.
7. Проба на выделение газов.
К нескольким каплям исследуемого раствора добавить 2-3 капли раствора H2SO4 и нагреть. В присутствии СО32-, S2О32-, SO32-, S2-, NO2- выделяется газ. Обратить внимание на свойства газа:
а) СО2 – бесцветный газ без запаха, вызывает, как и SO2, помутнение известковой воды.
б) SO2 – бесцветный газ с запахом горящей серы, вызывает восстановление растворов KMnO4 и I2.
в) NO2 – бурый газ с резким запахом, вызывает окисление I- до свободного йода.
г) H2S – бесцветный газ с характерным запахом, вызывающий почернение бумаги, смоченной [Pb(OH)4]2- Pb(CH3COO)2.
Обнаружение некоторых ионов дробным методом.
1. Открытие SO42-.
При наличии I группы анионов к нескольким каплям исходного раствора добавить раствор ВаСl2 и проверить растворимость в кислотах. Помнить, что мешает только совместное присутствие S2О32- и S2-.
2. Открытие СО32-.
СО32- - анион можно открыть из отдельной пробы раствора по помутнению известковой воды выделяющимся углекислым газом при действии кислот в специальном приборчике, состоящем из пробирки и пипетки с Са(ОН)2, закрепленной в пробке.
Для удаления путем окисления мешающих ионов SO32- и S2О32- к раствору необходимо добавить 2-3 капли 3% Н2О2.
3. Открытие РО43-.
Проводится реакцией с молибденовой жидкостью в азотнокислом растворе. Выпадение желтого кристаллического осадка после аккуратного нагревания в течение нескольких минут (лучше на водяной бане) свидетельствует о присутствии РО43-.
4. Открытие SiO32-.
К 4-5 каплям исследуемого раствора добавить 3-4 капли раствора NH4Cl и нагреть несколько минут на водяной бане. В присутствии SiO32- появляется белый аморфный осадок, иногда гель кремниевой кислоты.
5. Открытие Br-и I-.
Проводиться реакцией с хлорной водой в сернокислой среде и экстракцией бензолом последовательно выделяющихся I2 и Br2.
6. Открытие S2-.
О наличии S2- можно судить:
а) по цвету осадка, образующегося при действии AgNO3 и HNO3
б) по почернению бумаги, смоченной Pb(CH3COO)2 или [Pb(OH)4]2- в парах Н2S, получающегося при действии раствора Н2SO4 на часть исходного раствора и по запаху.
7. Открытие NCS-.
К нескольким каплям исходного раствора добавить каплю раствора, содержащего Fe3+. В присутствии тиоционат-ионов раствор окрашивается в розовый цвет.
8. Открытие СН3СОО-.
а) Упарить 1 мл исходного раствора до нескольких капель, добавить несколько капель раствора H2SO4, нагреть. Обнаружить выделяющуюся СН3СООН по запаху.
б) Провести с несколькими каплями исходного раствора реакцию получения этилацетата и обнаружить образующийся эфир по запаху.
Если в задаче присутствуют анионы, образующие с раствором серной кислоты газы с резким запахом, обнаружение СН3СОО- проводят в растворе после отделения I и II групп анионов.
9. О присутствии нитрит-иона можно судить по выделению NO2- при реакции с раствором H2SO4.
10. Удаление NO2-.
Перед открытием NO3- необходимо провести удаление NO2- реакцией с NH4Cl, так как NO2—анион вступает в одинаковые реакции с NO3-. Для удаления NO2- к нескольким каплям исходного раствора добавить твердый NH4Cl до насыщения и нагреть. Происходит реакция:
NH4+ + NO2- = N2↑+ 2H2O
Подобно солям аммония действует мочевина в кислой среде:
2 NO2- + Н+ + СО(NH2)2 = 3H2O +CO2 ↑+ 2N2↑
11. Открытие NO3-.
Обнаружение NO3- можно провести реакциями с металлической медью в сернокислой среде, с алюминием в щелочной среде или другими характерными реакциями.
Некоторые анионы лучше обнаружить, используя элементы систематического хода анализа.






