Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl - 2е- = Сl°2
Если при переходе сплава из жидкого состояния в твердое компоненты, составляющие сплав, не отделяются друг от друга, как это имеет место при образовании механической смеси, а продолжают оставаться в растворе, то получается структура, которая называется твердым раствором.
Твердый раствор только тем и отличается от жидкого, что атомы в нем расположены с известной геометрически правильной закономерностью в виде кристаллических решеток. Таким образом, твердым раствором называют такой вид взаимодействия между компонентами, образующими сплав, когда атомы одного компонента располагаются в кристаллической решетке другого, т. е. в процессе кристаллизации образуется общая кристаллическая решетка, в которой находятся атомы обоих компонентов. Очевидно, что если такой сплав рассматривать под микроскопом, то мы увидим однородные кристаллы твердого раствора; компоненты же, составляющие сплав, под микроскопом не будут различимы. При образовании твердого раствора один компонент является растворителем, а другой - растворимым.
Растворителем становится тот компонент, кристаллическая решетка которого сохраняется, а растворимым - тот, атомы которого располагаются в кристаллической решетке растворителя. Кристаллическая решетка твердого раствора сплава меди с никелем. Светлые шарики обозначают атомы меди, а черные - атомы никеля. Различают твердые растворы ограниченные и неограниченные. Так, например, железо с углеродом образует ограниченный твердый раствор, так как в кристаллической решетке железа может раствориться не более 2% углерода. Медь с никелем образуют неограниченные твердые растворы. Твердые растворы не отличаются постоянным составом. Например, могут встречаться твердые растворы железа с углеродом, содержащие 0,1, 0,5, 1,5% углерода и т. д.
74. p-Элементы имеют общую электронную конфигурацию ns2np1–6 и образуют подгруппы IIIА, IVА, VА, VIА, VIIА и VIIIА периодической системы.
В подгруппе IIIА рассматривают отдельно B, Al и подгруппу галлия (Ga, In, Tl), в IVА – C, Si и подгруппу германия (Ge, Sn, Pb), в VА – N, P и подгруппу мышьяка (As, Sb, Bi), в VIА – O и подгруппу халькогенов (S, Se, Te, Po), в VIIА – галогены (F, Cl, Br, I, At), в VIIIА – Ne, Ar и подгруппу криптона (Kr, Xe, Rn).
В отличие от s-элементов, p-элементы поливалентны. Высшие положительные степени окисления равны номеру группы, отрицательные – числу неспаренных электронов для элементов IVА–VIIА подгрупп. Для элементов подгруппы Kr возможны только формально положительные четные степени окисления.
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие. Так, в подгруппе IVА стабильность соединений Э2+ возрастает в ряду Ge2+ < Sn2+ < Pb2+. В той же последовательности уменьшается устойчивость соединений Э4+. Подтверждением этому служит изменение термической устойчивости водородных соединений ЭH4.
ЭH4 CH4 SiH4 GeH4 SnH4 PbH4
tразл, °C 800 450 285 150 0
приведены основные характеристики элементов IIIА–VIIА подгрупп.
Восстановительные свойства p-элементов в группе сверху вниз усиливаются, а окислительные ослабевают. Примером тому может служить изменение значений E° для Г2
F2 Cl2 Br2 I2
2,86 1,36 1,07 0,53
и реакции типа
Окислителями и восстановителями являются соединения, в которых элементы находятся в неустойчивых степенях окисления и в ходе реакции переходят в более устойчивые. Так, для элементов IVА подгруппы стабильность степени окисления +2 увеличивается с ростом порядкового номера. Если Ge+2 – сильный восстановитель, то Pb+4 – энергичный окислитель.
Окислительная активность Pb+4 проявляется в реакции при разрядке свинцового аккумулятора
Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Химические свойства
Гидроксид алюминия
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
с галогенами (кроме фтора)[6], образуя хлорид, бромид или иодид алюминия:
2Al + 3Hal2 = 2AlHal3 (Hal = Cl, Br, I)
с другими неметаллами реагирует при нагревании:
с фтором, образуя фторид алюминия:
2Al + 3F2 = 2AlF3
с серой, образуя сульфид алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):
2Al + 6H2O = 2Al(OH)3 + 3H2
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
75. Углеро́д ( химический символ — C) — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107[5].
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
МОНООКСИД УГЛЕРОДА (угарный газ, СО), бесцветный, лишенный запаха ядовитый газ, который образуется при неполном сгорании ископаемых топлив; он присутствует в составе угольного газа и выхлопных газов автомобилей. Ядовитое действие угарного газа заключается в том, что он связывает ГЕМОГЛОБИН в ЭРИТРОЦИТАХ (красных кровяных тельцах) и тем самым препятствует переносу кровью кислорода. (Это случается, если вдыхаемый воздух содержит всего лишь 0,1% угарного газа по объему). В металлургии монооксид углерода используют как восстановитель. Свойства: плотность 0,968 (воздух = 1), температура плавления -205 °С, температура кипения -191,5
ДИОКСИД УГЛЕРОДА
(син. углекислый газ, Д.у.) - СО2, продукт окисления соединений, содержащих углерод. Д.у. образуется при дыхании организмов и при сжигании топлива, содержащего углерод, а также при извержении вулканов и выветривании карбонатных горных пород. При повышении концентрации Д.у. в атмосфере формируется парниковый эффект. Содержание в атмосфере Д.у. до начала промышленной революции составляло 0,028 %, в настоящее время оно превышает 0,03%, к 2010 г. прогнозируется повышение концентрации Д.у. вдвое.
76. Карбиды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.)Карбиды — тугоплавкие твёрдые вещества, не растворимы[источник не указан 1313 дней] ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Карбиды могут быть образованы разными органическими соединениями, а могут не иметь аналогов среди органических веществ. Есть, например, ацетилениды, метаниды и другие.
Карбиды подразделяются на следующие виды:
солеобразные (CaC2, Al4C3),
ковалентные (карборунд SiC),
металлоподобные (имеющие нестехиометрический состав, например, цементит (Fe3C)).
Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны. Металлоподобные карбиды имеют промежуточную химическую активность.
Карбонаты, соли угольной кислоты H2CO3. Различают нормальные (средние) карбонаты, с анионом СО32- (например, KHCO3), кислые карбонаты (гидрокарбонаты или бикарбонаты), с анионом НСО-3 (например, КНСОз) и основные карбонаты [например, Cu2(OH)2СОз — минерал малахит]. В воде растворимы только нормальные карбонаты щелочных металлов, аммония и таллия. В результате значительного гидролиза растворы их показывают щелочную реакцию. Наиболее трудно растворимы нормальные карбонаты кальция, стронция, бария и свинца (2-валентного). Кислые карбонаты хорошо растворимы в воде. При нагревании карбонаты, как правило, разлагаются (CaCO3 = CaO + CO2) ещё до достижения точки плавления; исключение представляют карбонаты щелочных металлов и таллия. Гидрокарбонаты при нагревании переходят в нормальные карбонаты (2NaHCO3 = Na2CO3 + H2O + CO2). Сильными кислотами нормальные и кислые карбонаты разлагаются с выделением CO2 (K2CO3 + H2SO4 = K2SO4 + H2O + CO2). В природе нормальные карбонаты широко распространены, составляя одну из групп минералов (см. Карбонаты природные). Некоторые природные, нормальные и основные, карбонаты являются весьма ценными металлическими рудами; таковы карбонаты цинка, свинца, меди, железа, марганца и др. Нерудное сырьё — известняк CaCO3, магнезит MgCO3, витерит BaCO3 употребляют в строительном деле, в производстве огнеупоров, в химической промышленности и т.д. Из синтетических карбонатов в технике широко применяется сода (Na2CO3 и NaHCO3) и в меньшей степени — поташ K2CO3. Гидрокарбонаты выполняют важную физиологическую роль, являясь буферными веществами (см. Буферные системы). Об отдельных карбонатах см. Бария карбонат, Калия карбонат, Кальция карбонат, Магния карбонат, Натрия карбонат и др.
77. Силикаты и алюмосиликаты представляют собой обширную группу минералов. Для них характерен сложный химический состав и изоморфные замещения одних элементов и комплексов элементов другими. Главными химическими элементами, входящими в состав силикатов, являются Si, O, Al, Fe2+, Fe3+, Mg, Mn, Ca, Na, K, а также Li, B, Be, Zr, Ti, F, H, в виде (OH)1− или H2O и др.
Общее количество минеральных видов силикатов около 800. По распространённости на их долю приходится более 90 % минералов литосферы. Силикаты и алюмосиликаты являются породообразующими минералами. из них сложена основная масса горных пород: полевые шпаты, кварц, слюды, роговые обманки, пироксены, оливин и др. Самыми распространёнными являются минералы группы полевых шпатов и затем кварц, на долю которого приходится около 12 % от всех минералов
Структурные типы силикатов
В основе структурного строения всех силикатов лежит тесная связь кремния и кислорода; эта связь исходит из кристаллохимического принципа, а именно из отношения радиусов ионов Si (0.39Å) и O (1.32Å). Каждый атом кремния окружён тетраэдрически расположенными вокруг него атомами кислорода. Таким образом, в основе всех силикатов находятся кислородные тетраэдры или группы [SiO4]3, которые различно сочетаются друг с другом. В зависимости от того, как сочетаются между собой кремнекислородные тетраэдры, различают следующие структурные типы силикатов.
1. Островные силикаты, то есть силикаты с изолированными тетраэдрами [SiO4]4− и изолированными группами тетраэдров: а) силикаты с изолированными кремнекислородными тетраэдрами (См. схему, а). Их радикал [SiO4]4−, так как каждый их четырёх кислородов имеет одну валентность. Между собой эти тетраэдры непосредственно не связаны, связь происходит через катионы; б) Островные силикаты с добавочными анионами О2−, ОН1−, F1− и др. в) Силикаты со сдвоенными тетраэдрами. Отличаются обособленными парами кремнекислородных тетраэдров [Si2O7]6−. Один из атомов кислорода у них общий (см. Схему, б), остальные связаны с катионами. г) Кольцевые силикаты. Характеризуются обособлением трёх, четырёх или шести групп кремнекислородных тетраэдров, образующих кроме простых колец (см. Схему в, г), также и «двухэтажные». Радикалы их [Si3O9]6−, [Si4O12]8−, [Si6O18]2−, [Si12O30]18−. Представители: оливины, гранаты, циркон, титанит, топаз, дистен, андалузит, ставролит, везувиан, каламин, эпидот, цоизит, ортит, родонит, берилл, кордиерит, турмалин и др.
2. Цепочечные силикаты, силикаты с непрерывными цепочками из кремнекислородных тетраэдров (см. Схему, д, е). Тетраэдры сочленяются в виде непрерывных обособленных цепочек. Их радикалы [Si2O6]4− и [Si3O9]6−. Представители: пироксены ромбические (энстатит, гиперстен) и моноклинные (диопсид, салит, геденбергит, авгит, эгирин, сподумен, волластонит, силлиманит). Цепочечные силикаты характеризуются средними плотностью и твердостью и совершенной спайностью по граням призмы. Встречаются в магматических и метаморфических горных породах.
3. Поясные (Ленточные) силикаты, это силикаты с непрерывными обособленными лентами или поясами из кремнекислородных тетраэдров (см. Схему, ж). Они имеют вид сдвоенных, не связанных друг с другом цепочек, лент или поясов. Радикал структуры [Si4O11]6−. Представители: тремолит, актинолит, жадеит, роговая обманка.
4. Листовые силикаты, это силикаты с непрерывными слоями кремнекислородных тетраэдров. (см. Схему, з). Радикал структуры [Si2O5]2−. Слои кремнекислородных тетраэдров обособлены друг от друга и связаны катионами. Представители: тальк, серпентин, хризотил-асбест, ревдинскит, полыгорскит, слюды (мусковит, флогопит, биотит), гидрослюды (вермикулит, глауконит), хлориты (пеннит, клинохлор и др), минералы глин (каолинит, хризоколла, гарниерит и др.), мурманит.
5. Силикаты с непрерывными трёхмерными каркасами, или каркасные силикаты (см. Схему, и). В этом случае все атомы кислорода общие. Такой каркас нейтрален. Радикал [SiO2]0. Именно такой каркас отвечает структуре кварца. На этом основании его относят не к окислам, а к силикатам. Разнообразие каркасных силикатов объясняется тем, что в них присутствуют алюмокислородные тетраэдры. Замена четырёхвалентного кремния на трехвалентный алюминий вызывает появление одной свободной валентности, что в свою очередь влечет за собой вхождение других катионов (например калия и натрия). Обычно отношение Al к Si равно 1:3 или 1:1.
1 СТРОИТЕЛЬНАЯ КЕРАМИКА
1.1 Стеновые материалы
Стеновые материалы – один из наиболее древних искусственных строительных изделий. Его возраст – более 5 тыс. лет. Он широко применяется для строительства зданий и сооружений различного назначения. К стеновым материалам относят кирпич и керамические камни. Последние по размерам больше кирпича, имеющего форму параллелепипеда с размерами 250×120×65 и 250×120×83 мм. С целью улучшения теплоизоляционных свойств, снижения массы, расхода сырья и топлива кирпич и камни выпускаются со сквозными или несквозными пустотами.
Водопоглощение кирпича и камней составляет 6–8%.
Для производства стеновой керамики в качестве сырья используется преимущественно легко- и тугоплавкие глины, суглинки, а также глины с включением карбонатов, известняков и полевошпатовых пород.
1.2 Кровельные материалы
К кровельным материалам относится керамическая черепица (ленточная, коньковая), отличающаяся высокой огнестойкостью и малой теплопроводностью.
Исходными материалами для изготовления черепицы служат легкоплавкие глины повышенной пластичности, не засоренные включениями, обладающие хорошими формовочными и сушильными свойствами и дающие после обжига спекшийся прочный черепок. В качестве отощающих материалов применяют кварцевый песок, шамот и дегидратированную глину.
1.3 Изделия для облицовки фасадов
Фасадная керамика – прекрасный облицовочный материал, имеющий хороший внешний вид, долговечность, невысокую стоимость.
В строительстве наиболее экономична лицевая керамика (кирпич и камни), которые, кроме конструктивных, выполняют и декоративные функции. Кирпич вырабатывают с естественно окрашенной лицевой поверхностью или двухслойной. Лицевая поверхность может быть покрыта глазурью, ангобом, оплавлена плазмой.
Фасадные керамические плитки выпускают широкой цветовой гаммы, неглазурованные и покрытые глазурью. Водопоглощение их составляет 8–10%, должны обладать требуемой морозостойкостью.
1.4 Изделия для внутренней облицовки
К группе изделий для внутренней облицовки относят плитки керамические для полов, используемые в помещениях с влажным режимом, агрессивными (разрушающими) средами, там, где полы подвергаются значительному истиранию, или к чистоте помещений предъявляются повышенные требования; а также плитки для внутренней облицовки стен – для отделки внутренних вертикальных поверхностей зданий.
Плитки выпускают различных типов и размеров. Водопоглощение не должно превышать 16%, из полиминеральных глин – 24%. Сырьем служат глины и каолины, отощители – кварцевый песок, жженый каолин, бой (брак) изделий. В качестве плавней применяются нефелин-сиенит, перлит, шлаки, мел, стеклобой в сочетании с мелом, тальком, доломитом, волластонитом.
1.5 Изделия для подземных коммуникаций
Дренажные трубы – служат основным материалом при мелиоративных работах для устройства водоотводных сетей, понижающих уровень грунтовых вод а сельском хозяйстве, строительстве сооружений и дорог.
Для производства дренажных труб используют в основном легкоплавкие глины, аналогичные используемым в производстве кирпича. В качестве отощителя используют кварцевый песок, дегидратированную глину, шамот; выгорающими добавками служат уголь, топливные шлаки, опилки. Черепок труб пористый с водопоглощением не более 18%.
Канализационные керамические трубы предназначены для транспортировки сточных вод и жидких отходов производств в хозяйственных и промышленных канализационных сетях. Керамический черепок труб плотный (водопоглощение не более 9%), водонепроницаемый и химически стойкий (кислотостойкость не менее 0,2%). Основное сырье – тугоплавкие или огнеупорные глины, в качестве отощителя используют шамот, полученный из тугоплавких глин.
1.6 Санитарные керамические изделия
Санитарные керамические изделия – умывальники, унитазы, бачки смывные и др., устанавливаемые в санитарных узлах жилых, общественных и промышленных зданий.
Изготавливают санитарную керамику из фаянсовых, полуфарфоровых и фарфоровых масс. Для их производства применяются беложгущиеся огнеупорные и тугоплавкие глины, содержащие 27–35% глинозема, до 2–5% красящих оксидов.
1.7 Пористые заполнители
Керамзит – гранулированный вспученный материал, имеющий в изломе структуру застывшей пены. Его выпускают в виде гравия (размер зерен составляет 5–40 мм) и песка (менее 5 мм).
Аглопорит – искусственный пористый материал, выпускаемый в виде щебня (фракции 5-40 мм) и песка (менее 5 мм).
Для пористых заполнителей – керамзита и аглопорита применяются легкоплавкие глинистые породы (лесс, суглинок, сланцы глинистые) с добавками угля, шлака, опилок и др. Глинистая составляющая должна обладать способностью вспучиваться при нагревании за счет образования вязкого силикатного расплава и одновременного выгорания газообразующих продуктов.
Техническая керамика
В основу классификации технической керамики положен признак наличия в изготовленном керамическом изделии определенного химического состава кристаллической фазы, преобладающей в этом виде керамики. Такой признак классификации позволяет объединить все существующие виды технической керамики в несколько основных классов.
Оксидная керамика.
К этому классу относится керамика из высокоогнеупорных оксидов – огеупорные изделия, конструкционные детали, химически стойкие и электроизоляционные изделия, атомная энергетика, авиация. Оксидную керамику изготавливают на основе оксидов А12О3, ZrO2, BeO, MgO, CaO, SiO2, ThO2,UO2.
Керамика на основе силикатов и алюмосиликатов.
Муллитовая, муллитокорундовая, клиноэнстатитовая, форстеритовая, кордиеритовая, цельзиановая, цирконовая, литийсодержащая, волластонитовая керамика на основе силикатов и алюмосиликатов применяется в электронике, радио- и электротехнике, вакуумной технике.
Керамика на основе диоксида титана, титанатов, цирконатов, ниобатов и их соединений с пьезоэлектрическими свойствами применяется в радио- и электронике, конденсаторной технике для пьезоэлементов, в радиоэлектронике.
Керамика на основе шпинелей (магнезиальная шпинель) находит применение в качестве огнеупоров, в электровакуумной и радиоэлектронике.
Керамика на основе хромитов редкоземельных элементов следующих видов: феррошпинель, хромитов лантана и иттрия используется в качестве высокотемпературных нагревателей, электропроводящих элементов, электронике и радиотехнике.
Керамика на основе тугоплавких бескислородных соединений (карбиды, нитриды, бориды, силициды) применяются как огнеупорные изделия, конструкционные детали, электронагреватели.
Композиционные материалы применяются в качестве огнеупорных и конструкционных материалов, электронагревателей.
Исходными компонентами для производства технической керамики являются чистые оксиды, которые подвергают, как правило, прокаливанию с целью стабилизации фазового состава, улетучивания влаги и легкоплавких примесей.
4 Огнеупоры
К огнеупорам относятся материалы и изделия, способные выдерживать механические и физико-химические воздействия при высоких температурах и применяемые для кладки различных теплотехнических агрегатах. Различают изделия огнеупорные (1580–1750°С), высокоогнеупорные (1770–2000°С) и высшей огнеупорности (>2000°С). По химическому составу огнеупоры делят на 11 типов – кремнеземистые, алюмосиликатные, магнезиальные, магнезиально-известковые, магнезиально-шпинелидные, магнезиально-силикатные, углеродистые, карбид-кремниевые, цирконистые, оксидные, бескислородные.
К кремнеземистым огнеупорам относятся динас и кварцевая керамика, изготавливаемые на основе кремнезема.
Динас обладает большой огнеупорностью (1710–1730°С), очень высокой температурой деформации под нагрузкой (1670°С), хорошей устойчивостью к кислым расплавам, поэтому используется для кладки сводов печей, влетов горелок, насадок регенераторов.
Кварцевая керамика – высокотемпературный материал с низким температурным коэффициентом линейного расширения (ТКЛР 5×10-7 К-1), обладающий высокой механической прочностью и химической стойкостью. Применяется в атомной, ракетной и других областях новой техники
Алюмосиликатные огнеупоры получены на основе двухкомпонентной системы Al2O3–SiO2. По содержанию Al2O3 они подразделяются на полукислые (10–28%), шамотные (28–45%) и высокоглиноземистые (>45%). Сырьем служат природные гидраты алюминия, технический глинозем, огнеупорные глины. Применяются для кладки большинства теплотехнических агрегатов.
Название магнезиальные огнеупоры определяет несколько типов и разновидностей огнеупоров, общий признак которых – наличие оксида магния. применяются для кладки печей и других агрегатов.
К углеродсодержащим огнеупорам относятся изделия, изготовленные из углерода и его соединений. Они подразделяются на графитовые, углеродистые и карборундовые. Изделия отличаются сверхвысокой огнеупорностью, высокими тепло- и электропроводностью, а также температурой деформации под нагрузкой, постоянством размеров и несмачиваемостью шлаками. Недостатками этих огнеупоров является сильная окисляемость при эксплуатации. Изделия применяются в ракетостроении, ядерной технике, черной и цветной металлургии, химической, газовой и других отраслях промышленности.
Полупроводни́к — материал, который по своей удельной проводимости занимает промежуточное место между проводниками и диэлектриками и отличается от проводников сильной зависимостью удельной проводимости от концентрации примесей, температуры и воздействия различных видов излучения. Основным свойством полупроводника является увеличение электрической проводимости с ростом температуры.[1]
Полупроводниками являются вещества, ширина запрещённой зоны которых составляет порядка нескольких электрон-вольт (эВ). Например, алмаз можно отнести к широкозонным полупроводникам, а арсенид индия — к узкозонным. К числу полупроводников относятся многие химические элементы (германий, кремний, селен, теллур, мышьяк и другие), огромное количество сплавов и химических соединений (арсенид галлия и др.). Почти все неорганические вещества окружающего нас мира — полупроводники. Самым распространённым в природе полупроводником является кремний, составляющий почти 30 % земной коры
В зависимости от того, отдаёт ли примесной атом электрон или захватывает его, примесные атомы называют донорными или акцепторными. Характер примеси может меняться в зависимости от того, какой атом кристаллической решётки она замещает, в какую кристаллографическую плоскость встраивается.
Проводимость полупроводников сильно зависит от температуры. Вблизи температуры абсолютного нуля полупроводники имеют свойства диэлектриков.
78. азот -3ст. аммиак Нитриды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны менее электроотрицательного элемента, при этом образуя стабильную электронную конфигурацию s2p6)или отдавать электрон партнеру с образованием устойчивой конфигурации sp3). В первом случае нитриды характеризуются наличием ионной связи, во втором химическая связь является типично металлической. В обоих случаях присутствует также некоторая доля ковалентной составляющей. В соединениях азота с бором и кремнием преобладает ковалентный характер химической связи.
Ионная связь наблюдается а нитридах металлов I и II групп Периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Азот в аммиаке имеет наименьшую степень окисления и поэтому проявляет только восстановительные свойства. Так, например, при горении аммиака образуются азот и вода:
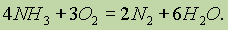
Азот +3 Оксид азота(III) (азотистый ангидрид, сесквиоксид азота) N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Азотистая кислота и нитрит-ион проявляют окислительные (переход в NO) и восстановительные (переход в) свойства в зависимости от природы реагента. При составлении уравнений реакций, проходящих в нейтральных и щелочных растворах, используется формула нитрит-иона, а в кислотных растворах – формула азотистой кислоты НNO2.
Азот+5. Азотная кислота Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NO3-, имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ:

Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее HNO3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NO2; если HNO3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.
Чтобы восстановление HNO3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.
79.



80.

Так как все галогены имеют на внешнем электронном слое семь электронов, то они являются сильными окислителями. Но в группе сверху вниз с увеличением радиуса атома уменьшаются окислительные свойства и увеличиваются восстановительные свойства. Поэтому более сильным восстановителем будет атом с пятью электронными слоями, а более сильным окислителем является фтор. Так, в отличие от всех галогенов, иод реагирует с азотной кислотой, проявляя восстановительные свойства:

Самый сильный галоген — фтор вытесняет все ниже стоящие галогены из растворов их кислот и солей:

Иод не вытесняет ни один из галогенов из растворов кислот и солей.
81. К d- элементам относятся 32 элемента периодической системы IV–VII больших периодов. В IIIБ-группе у атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки (n-1)dansb, где a=1?10, b=1?2. С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-эле-ментов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта [Co(CO)5]);
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4, который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):

Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:

Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)[17].
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:

Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается[18] в виде Fe(OH)3:
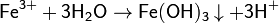
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:

Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
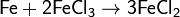
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-.[19] Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:

Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи[20], например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:

Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода:[21]:

Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа VII и VIII
Имеются сообщения об электрохимическом получении соединений железа(VIII).[22],[23],[24], однако независимых работ, подтверждающих эти результаты, нет.
82. Подгру́ппа ме́ди — химические элементы 11-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы I группы)[1]. В группу входят переходные металлы, из которых традиционно изготавливают монеты: медь Cu, серебро Ag и золото Au. На основании строения электронной конфигурации, к этой же группе относится и рентгений Rg, но в «монетную группу» он не попадает (это недолго живущий трансактинид с периодом полураспада 3.6 сек). Название монетные металлы официально не применяется к 11 группе элементов, поскольку для изготовления монет используются и другие металлы, такие как алюминий, свинец, никель, нержавеющая сталь и цинк.
Свойства
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но оносительно небольшие температур плавления и кипения, высокая тепло- и электропроводность.
Свойства металлов подгруппы меди [2]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | P г/см³ | tпл, °C | tкип, °C |
| Медь Cu Серебро Ag Золото Au | [Ar] 3d104s1 [Kr] 4d105s1 [Xe] 4f145d106s1 | 0, +1, +2 0, +1, +3 0, +1, +3 | 8,96 10,5 19,3 | 960,8 1063,4 |
Особенностью элементов подгруппы является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[7]
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2 2CuO
Cu + Cl2 CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(конц.) CuSO4 + SO2+2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 [Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 CuSO4 + H2O
CuO + 2HNO3 Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl CuCl2 + 2H2O
Cu(OH)2 + 2H+ Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3[Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 2CuO + CO2 + H2O
Дополнительную информацию о меди, её свойствах и применении можно получить здесь
Серебро и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S + O2 2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(разб.)3AgNO3 + NO + 2H2O
Ag + 2HNO3(конц.) AgNO3 + NO2+ H2O
2Ag + 2H2SO4(конц.) Ag2SO4 + SO2 + 2H2O
В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- AgClбелый
Ag+ + Br- AgBr светло-жёлтый
Ag+ + I- AgI тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH
Золото и его соединения
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот ("царской водке"):
Au + HNO3 + 4HCl H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Химические свойства
-Химическая активность уменьшается с увеличением атомной массы (в главной подгруппе –наоборот).
-Хорошие комплексообразователи (в отличие от элементов главной подгруппы).
Цинк и его соединения
Цинк - металл серебристо-белого цвета. В соединениях проявляет только одну степень окисления +2; соединения цинка неокрашены.
Нормальный окислительно-восстановительный потенциал в кислой среде системы Zn2+ / Zn равен -0,76 в, а в щелочной среде системы ZnO22- / Zn равен -1,22 в. Поэтому цинк растворяется в разбавленных кислотах и щелочах
Zn + 2НCl ZnCl2 + H2
Zn + H2SO4(разб) ZnSO4 + H2
Zn + 2NaOH + 2H2O Na2[Zn(OH)4] + H2
Цинк не разлагает воду, т.к. в водном растворе он быстро покрывается защитной пленкой оксида, которая предохраняет его от коррозии.
Цинк - сильный восстановитель и вытесняет менее активные металлы (стоящие справа в ряду напряжений) из растворов их солей
Zn + CuSO4 ZnSO4 + Cu
Оксид цинка проявляет амфотерный характер, растворяясь как в кислотах, так и в растворах щелочей:
ZnO + H2SO4 ZnSO4 + H2O
ZnO + 2NaOH + H2O Na2[Zn(OH)4]
При нагревании комплексный тетрагидроксицинкат-анион дегидратируется:
[Zn(OH)4]2- ZnO22- + 2H2O
Гидроксид цинка также проявляет амфотерные свойства. Он нерастворим в воде, но растворяется в кислотах и щелочах;
Zn(OH)2 + 2HCl ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
Ион Zn2+ является энергичным комплексообразователем с координационным числом 4. В отличие от гидроксида алюминия гидроксид цинка растворяется в водном растворе аммиака:
Zn(OH)2 + 2NH3 [Zn(NH3)4](OH)2
Кадмий и его соединения
Кадмий - белый, блестящий, мягкий, ковкий металл; очень мало растворяется в неокисляющих кислотах, хорошо растворяется в разбавленной HNO3 (нормальный потенциал Cd / Cd 2+ = -0,40 в).
Кадмий образует только один ряд соединений, где он двухвалентен. Ион Сd 2+ - бесцветен.
Оксид кадмия СdО (коричневого цвета) и гидроксид кадмия Сd(ОН)2 (белого цвета) проявляют основной характер, растворяясь только в кислотах.
CdO + 2HCl CdCl2 + H2O
Cd(OH)2 + 2HCl CdCl2 + 2H2O
Кадмий является хорошим комплексообразователем (координационное число 4). Гидроксид кадмия растворяется в водном растворе аммиака:
Cd(OH)2 + 4NH3 [Cd(NH3)4](OH)2
Ртуть и ее соединения
Ртуть - серебристо-белый, блестящий, единственный жидкий при комнатной температуре металл; обладает низкой электропроводностью (она составляет 1,7% от электропроводности серебра) и большим коэффициентом термического расширения. На воздухе проявляет устойчивость. Реагирует с серой и галогенами:
Hg + S HgS
Hg + Br2 HgBr2
Со многими металлами дает сплавы (амальгамы) (экзотермическое образование). Пары и соединения чрезвычайно ядовиты (накапливаются в организме).
Ртуть не растворяется в соляной и разбавленной серной кислотах (в ряду напряжений металлов ртуть находится после водорода; нормальный потенциал Hg / Hg 2+ = +0,85 в). Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Hg + 4HNO3 Hg(NO3)2 + 2NO2 + 2H2O
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (I),
6Hg + 8HNO33Hg2(NO3)2 + 2NO + 4H2O
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
Hg + 2H2SO4HgSO4 + SO2+ 2H2O
2Hg + 2H2SO4 Hg2SO4 + SO2 + 2H2O
Ртуть растворяется в царской водке:
3Hg + 2HNO3 + 6HCl3HgCl2 + 2NO+ 4H2O
Оксид ртути (II) HgO; красный кристаллический или желтый аморфный порошок; плохо растворим в воде; раствор имеет слабо щелочную реакцию.<
Получение
3000 C
2Hg + O2
2HgO
4000 C
Hg2(NO3)2 2HgO + 2NO2
2Hg(NO3)2 2HgO + 4NO2 + O2
Химические свойства.
Легко восстанавливается; при нагревании разлагается на ртуть и кислород. Реагирует с кислотами с кислотами с образованием солей и воды.
Сульфид ртути (II) HgS (киноварь) – ярко-красный нерастворимый в воде порошок.
Hg + S HgS
Hg2+ + S2- HgS
Галогениды.
Получение
Hg + Br2 HgBr2
HgO + 2HCl(сулема) HgCl2 + H2O
Сулему также получают растворением ртути в царской водке.
Химические свойства:
HgI2 + 2KI K2[HgI4](реактив Несслера)
Реактив Несслера используется в качестве очень чувствительного аналитического реагента для обнаружения иона NH4+:
Сульфат ртути (II) и нитрат ртути (II). Получают растворением ртути или оксида ртути (II) в концентрированных серной или азотной кислотах соответственно.
Hg + 2H2SO4(горячая,конц.) HgSO4 + SO2 + 2H2O
HgO + H2SO4 HgSO4 + H2O
3Hg + 8HNO3(конц.) 3Hg(NO3)2 + 2NO + 4H2O
HgO + 2HNO3 Hg(NO3)2 + H2O
Более активные металлы легко вытесняют ртуть из ее солей:
Cu + Hg(NO3)2 Cu(NO3)2 + Hg
83. В органических топливах теплота выделяется в результате химической реакции окисления его горючих частей при участии кислорода, а в ядерных топливах – в результате распада деления ядер тяжелых элементов (урана, плутония и т.д.).
Таблица 13.2
| Топливо | Твердое | Жидкое | Газообразное |
| Природное | Дрова, торф, бурые и каменные угли, антрацит, горючие сланцы | Нефть | Природный газ |
| Искусственное | Древесный уголь, полукокс, кокс, угольные и торфяные брикеты | Мазут, керосин, бензин, соляровое масло, газойль, печное топливо | Газы нефтяной, коксовый, генераторный, доменный, газ подземной газофикации |
Твердые и жидкие топлива состоят из горючих (углерода - С, водорода - Н, летучей серы - Sл == Sор + Sк) и негорючих (азота - N и кислорода - О) элементов и балласта (золы - А, влаги - W).
Элементарный состав твердого и жидкого топлива дается в процентах к массе 1 кг топлива. При этом различают рабочую, сухую, горючую и органическую массу топлива.
Рабочая масса – это масса и состав топливо, в котором поступает к потребителю и подвергается сжиганию.
Состав рабочей, горючей, сухой и органической массы обозначается соответственно индексами "р", "с", "г" и "о" и выражаются следующими равенствами:
Ср + Нр + Sрл + Nр + Oр + Aр + Wр = 100 %; (13.1)
Сс + Нс + Sсл + Nс + Oс + Aс = 100 %. (13.2)
Сг + Нг + Sгл + Nг + Oг = 100 %; (13.3)
Со + Но + Sоорг + Nо + Oо = 100 %. (13.4)
Органическая масса топлива в отличии от горючей массы содержит только органическую серу и не включает колчеданную:
Sоорг = Sол - Sок. (13.5)
Коэффициенты пересчета состава топлива из одной массы в другую приведены в табл. 13.3.
Т а б л и ц а 13.3
| Заданная масса топлива | Коэффициенты пересчета на массу | ||
| рабочую | горючую | сухую | |
| Рабочая | 100/[100 - (Aр + Wр)] | 100/(100 - Wр) | |
| Горючая | [100 - (Aр + Wр)]/100 | (100 - Aс)/100 | |
| Сухая | (100 - Wр) / 100 | 100 / (100 - Aс) |
Для сланцев состава (Ср, Нр, Sрл, Nр, Oр, Aр, Wр) пересчет с рабочей
массы на горючую осуществляется с помощью коэффициента:
К = 100 / [100 - Aри - Wр - (СО2)рк], (13.6)
где Aри - истинная зольность рабочей массы, %·, Wр - влажность рабочей массы, %, (СО2)рк - содержание углекислоты карбонатов, %. Истинная зольность рабочей массы определяется по формуле
Aри = Aр - [2,5(Sра - Sрс) +0,375Sрк] [(100 - Wр) / 100], (13.7)
где Sра - содержание серы в лабораторной золе в процентах к массе топлива; Sрс - содержание сульфатной серы в топливе, %.
Величина [2,5(Sра - Sрс) +0,375Sрк] для ленинградских и эстонских сланцев может быть принята равной 2,0, для кашпирских - 4,1.
Пересчет состава (%) рабочей массы топлива при изменении влажности производится по формулам:
Ср2 = Ср1(100 - Wр2) / (100 - Wр1) ö
Hр2 = Hр1(100 - Wр2) / (100 - Wр1) ý, (13.8)
.................................................. ø
где Wр1 - начальная влажность топлива, %, Wр2 - конечная влажность топлива, %.
Средний состав (%) смеси двух твердых или жидких топлив, заданных массовыми долями, - первого (Ср2, Hр2....)и второго (Ср1, Hр...) - определяется по уравнениям:
Срсм = b1 Cр1 + (1 - b1) Cр2, ö
Hрсм = b1 Hр1 + (1 - b1) Hр2, ý, (13.9)
.......................................... ø
где массовая доля b1 одного из топлив в смеси находится по формуле:
b1 = В1 /(В1 + В2). (13.10)
Здесь В1 и В2 - массы топлив, входящих в смесь, кг.
Газообразное топливо представляет собой смесь горючих и негорючих газов. Горючая часть состоит из предельных (?СnH2n+2) и непредельных (?СnH2n) углеводородов, водорода Н2, окиси углерода СО, и сернистого водорода (Н2S). В состав негорючих элементов входит азот (N2), углекислый газ (СO2)и кислород (О2). Составы природного и искусственного газообразных топлив различны. Природный газ характеризуется высоким содержанием метана (СH4), а также небольшого количества других углеводородов: этана (С2H6), пропана (С3H8), бутана (С4H10), этилена (С2H4), и пропилена (С3H6). В искусственных газах содержание горючих составляющих (водорода и окиси углерода) достигает 25-45%, в балласте преобладают азот и углекислота – 55-75%.
Состав газообразного топлива задается в объемных долях и в общем виде можно записать следующим образом:
SСnH2n+2 + SСnH2n + Н2 + СО + Н2S + О2 + N2 + CО2 = 100%, (13.11)
где SСnH2n+2 – предельные углеводороды;
SСnH2n – непредельные угловодороды;
Н2S – сернистый водород.
СО – окись углерода;
CО2 - углекислый газ.
84. Полиме́ры (греч. πολύ- — много; μέρος — часть) — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются.[1] Как правило, полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов.[2]
Если связь между макромолекулами осуществляется с помощью слабых сил Ван-Дер-Ваальса, они называются термопласты, если с помощью химических связей — реактопласты. К линейным полимерам относится, например, целлюлоза, к разветвлённым, например, амилопектин, есть полимеры со сложными пространственными трёхмерными структурами.
В строении полимера можно выделить мономерное звено — повторяющийся структурный фрагмент, включающий несколько атомов. Полимеры состоят из большого числа повторяющихся группировок (звеньев) одинакового строения, например поливинилхлорид (—СН2—CHCl—)n, каучук натуральный и др. Высокомолекулярные соединения, молекулы которых содержат несколько типов повторяющихся группировок, называют сополимерами или гетерополимерами.
Полимер образуется из мономеров в результате реакций полимеризации или поликонденсации. К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, полисахариды, каучук и другие органические вещества. В большинстве случаев понятие относят к органическим соединениям, однако существует и множество неорганических полимеров. Большое число полимеров получают синтетическим путём на основе простейших соединений элементов природного происхождения путём реакций полимеризации, поликонденсации и химических превращений. Названия полимеров образуются из названия мономера с приставкой поли-: полиэтилен, полипропилен, поливинилацетат и т. п.
Классификация
По химическому составу все полимеры подразделяются на органические, элементоорганические, неорганические.
Органические полимеры.
Элементоорганические полимеры. Они содержат в основной цепи органических радикалов неорганические атомы (Si, Ti, Al), сочетающиеся с органическими радикалами. В природе их нет. Искусственно полученный представитель — кремнийорганические соединения.
Следует отметить, что в технических материалах часто используют сочетания разных групп полимеров. Это композиционные материалы (например, стеклопластики).
По форме макромолекул полимеры делят на линейные, разветвлённые (частный случай — звездообразные), ленточные, плоские, гребнеобразные, полимерные сетки и так далее.
Полимеры подразделяют по полярности (влияющей на растворимость в различных жидкостях). Полярность звеньев полимера определяется наличием в их составе диполей — молекул с разобщённым распределением положительных и отрицательных зарядов. В неполярных звеньях дипольные моменты связей атомов взаимно компенсируются. Полимеры, звенья которых обладают значительной полярностью, называют гидрофильными или полярными. Полимеры с неполярными звеньями — неполярными, гидрофобными. Полимеры, содержащие как полярные, так и неполярные звенья, называются амфифильными. Гомополимеры, каждое звено которых содержит как полярные, так и неполярные крупные группы, предложено называть амфифильными гомополимерами.
По отношению к нагреву полимеры подразделяют на термопластичные и термореактивные. Термопластичные полимеры (полиэтилен, полипропилен, полистирол) при нагреве размягчаются, даже плавятся, а при охлаждении затвердевают. Этот процесс обратим. Термореактивные полимеры при нагреве подвергаются необратимому химическому разрушению без плавления. Молекулы термореактивных полимеров имеют нелинейную структуру, полученную путём сшивки (например, вулканизация) цепных полимерных молекул. Упругие свойства термореактивных полимеров выше, чем у термопластов, однако, термореактивные полимеры практически не обладают текучестью, вследствие чего имеют более низкое напряжение разрушения.






