Самою активною фракцією фізичної глини дрібнозему ґрунту є колоїди. Колоїдами називаються дрібні часточки речовини, що мають розміри від 0,1 до 0,001 мк. Такі часточки речовини невидимі неозброєним оком, а наявність їх у розчині свідчить про те, що цей розчин не істинний. При відсутності колоїдів у розчині в останньому є лише молекули та іони мінеральних і органічних речовин — це істинний розчин. Молекули гумусових речовин належать до колоїдів, оскільки мають велику молекулярну масу.
Колоїдні часточки утворюються у природному середовищі двома шляхами: дисперсійним (подрібненням мінеральних уламків до розмірів колоїдних часточок) і конденсаційним (сполученням, ущільненням іонів і молекул). У колоїдних системах розрізняють дисперсну фазу (власне колоїдна часточка) і дисперсійне середовище (речовина, що знаходиться навколо колоїдної часточки: вода, повітря або тверде мінеральне середовище).
У ґрунті колоїди знаходяться у двох станах: у вигляді золя (колоїдний розчин) та у вигляді геля (колоїдний осад). Гелі ґрунту здатні зв'язувати та склеювати більш великі механічні елементи (мул, пил) в окремі агрегати різної величини і форми, які називають агрегатами, або структурними утвореннями. Від склеюючої властивості колоїдів (від лат. соїіа — клей) виникла їх назва.
У водному середовищі поведінка колоїдних часточок описується законами броунівського руху. Колоїди здатні проникати крізь звичайні паперові фільтри, а в клітинах живих організмів — крізь мембрани.
Найважливішою властивістю колоїдів є наявність на їхній поверхні електростатичного заряду. Колоїдні часточки з однойменними зарядами відштовхуються, а з різнойменними — притягаються (заряд може нейтралізуватись). Електронейт-ральна колоїдна часточка називається міцелою (рис. 1). Вона складається з ядра, розмір якого від 0,1 до 0,001 мк. У ґрунтах знаходиться понад 90% колоїдів, ядра яких представлені кристалічними уламками мінералів. На поверхні ядра знаходиться потенціалвизначаючий шар, що визначає заряд колоїду. Ядра колоїдів, що мають у потенціал визначаючому шарі аніони, називаються ацидоїдами (у ґрунті більшість таких колоїдів). Якщо в потенціал визначаючому шарі є катіони, то такі колоїди називаються базоїдами. Є ще третя група колоїдів, які називають ам-фолітоїдами. Вони здатні змінювати знак заряду (залежно від зміни реакції середовища). При наявності заряду на поверхні ядра навкруги колоїду в дисперсійному середовищі (вода) утворюється дифузний шар. В ацидоїдів у дифузному шарі знаходяться катіони, у базоїдів — аніони, в амфолітоїдів — катіони або аніони (залежно від зміни реакції середовища).
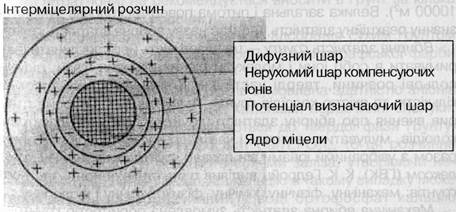
Рис. 1. Схема будови міцели ацидоїдного колоїду (за М. І. Горбуновим)
Ґрунтові колоїди бувають гідрофільними і гідрофобними, тобто їхній стан зумовлюють дипольні властивості води. Гідрофільними називаються такі колоїди, які здатні притягувати до своєї поверхні молекули води. Отже, утворюється багатошарова гідратна плівка (стан золя). Гідрофільність колоїдів посилюється при наявності в ґрунтовому розчині одновалентних катіонів, особливо катіонів натрію. Тоді колоїдна система ґрунту знаходиться в стані пептизації, тобто всі колоїдні часточки відокремлені чи зок-ремлені. Об'єднанню їх протидіють гідратні оболонки разом з катіонами натрію. При зволоженні такої ґрунтової маси відбувається її запливання, текучість, що призводить до різкого погіршення умов росту і розвитку рослин.
Гідрофобність ґрунтових колоїдів посилюється у присутності дво- і тривалентних катіонів, енергія взаємодії яких перевищує енергію диполя води. Наприклад, катіони кальцію легко відштовхують молекулу води від поверхні колоїдів, нейтралізують поверхневий заряд колоїдів. Звільнившись від гідратної плівки, такі нейтральні колоїди можуть випадати в осад. Відбувається явище коагуляції з утворенням геля (колоїдного осаду), яке супроводжується склеюванням механічних елементів ґрунту та агрегацією мінеральної маси, що призводить до поліпшення властивостей ґрунтів.
Внаслідок малих розмірів колоїди мають велику загальну поверхню. Так, якщо наповнити колоїдами посудину об'ємом 1 мл, то їх загальна поверхня буде дорівнювати майже 1 га (від 6000 до 10000 м2). Велика загальна і питома поверхня колоїдів зумовлює, значну реакційну здатність, що має назву вбирна здатність ґрунту.;
Вбирна здатність ґрунту — це властивість його поглинати (затримувати в собі) іони і молекули різних речовин, гази, рідини, сольові розчини, тверді часточки. її величина визначається кількістю та якістю колоїдів ґрунту. Академік К. К. Гедройц створив вчення про вбирну здатність ґрунту. Сукупність ґрунтових колоїдів, мулуватих часточок і частково часточок дрібного пилу разом з увібраними іонами він назвав ґрунтовим вбирним комплексом (ГВК). К. К. Гедройц виділив п'ять видів вбирної здатності; ґрунтів: механічну, фізичну, хімічну, фізико-хімічну і біологічну.
Механічна вбирна здатність зумовлена пористістю ґрунтової маси. Ґрунт затримує у своїй товщі часточки, що більші за розміри його пор. Величина механічного вбирання залежить від гранулометричного і структурного складу, складення ґрунтів. Завдяки механічному вбиранню утворюється мулуватий осад у заплавних і зрошуваних ґрунтах, проходить очищення стічних вод у ролях фільтрації та у відстійниках, утворюється ілювіальний горизонт у ґрунтах з промивним типом водного режиму.
Фізична вбирна здатність ґрунтів означає зміну концентрації розчиненої речовини на межі розділу дисперсійного середовища і дисперсної фази. Фізичне вбирання залежить від кількості колоїдів ґрунту, що здатні фізично (на основі дії електростатичних сил) вбирати заряджені часточки (диполі води, катіони, аніони), створюючи різну концентрацію їх у ґрунтовому розчині.
Зміна концентрації речовини на поверхні розділу двох фаз, що зумовлена властивостями поверхні колоїдів, називається адсорбцією. У ґрунтах найбільш поширена позитивна адсорбція, при якій відбувається збільшення концентрації речовини на поверхні колоїдів. Значно рідше зустрічається негативна адсорбція, тобто зменшення концентрації речовин на поверхні дисперсної фази та її збільшення в дисперсійному середовищі. Таке явище характерне для аніонів, які можуть втрачатись з ґрунту при низхідному пересуванні води. В одних випадках це явище позитивне, наприклад при відмиванні солеутворюючих аніонів (хлор, сульфат-іони), а в інших — негативне, наприклад при втраті нітратів, фосфатів та інших поживних речовин. Тому добрива, що мають нітрат-іони, не рекомендується вносити в ґрунт за кілька місяців до посіву або восени.
Прикладом фізичного вбирання є адсорбція сухим ґрунтом пари води з повітря, адсорбція чорнила і типографської фарби на папері.
Хімічна вбирна здатність ґрунтів зумовлена здатністю аніонів розчинених солей утворювати з катіонами нерозчинні сполуки, Що випадають в осад і примішуються до твердої фази ґрунту. Якщо в ґрунт внести суперфосфат Са(Н2РO4)2, то ця розчинна сіль може вступати в реакцію з солями заліза, утворюючи нерозчинний осад РеР04. З солями кальцію в такому випадку може Утворюватись важкорозчинний у воді ортофосфат кальцію Са3(РO4)2. Дуже часто в ґрунтах при хімічному вбиранні проходить нагромадження в карбонатному горизонті важкорозчинно-г° У воді кальциту СаСO3.
Фізико-хімічна, або обмінна, вбирна здатність зумовлена обміном деякої частини іонів, що знаходяться на поверхні твердої фази, на еквівалентну (рівновелику) кількість іонів, що знаходяться в оточуючому її розчині. Обмінне поглинання здійснюється за рахунок іонів, що розташовані на зовнішніх рівнях колоїдних часточок — дифузному шарі колоїдних міцел.
При контакті ґрунту з будь-яким розчином солі відбувається обмінна реакція: катіони солі поглинаються твердою фазою, а в розчин витісняються в еквівалентній кількості катіони з твердої фази. Так, якщо невелику кількість дерново-підзолистого ґрунту помістити на паперовий фільтр у лійці і налити розчин хлориду калію, то в фільтраті буде розчин соляної кислоти, який легко виявити за допомогою індикатора:
[ГВК] Н+ + НСІ ↔[ГВК] К+ + НСІ.
Якщо в аналогічному досліді використати зразок чорнозему, що насичений кальцієм, то реакція обміну катіонами проходить так:
[ГВК] Са2+ + 2КСІ ↔ [ГВК] 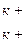 + СаСl2.
+ СаСl2.
Як видно з наведених рівнянь реакцій, на поверхні твердої фази ґрунту відбувається фізичне поглинання катіонів (адсорбція), а в ґрунтовому розчині — перетворення одних речовин на інші, тобто хімічне явище. Тому цей вид вбирної здатності ґрунтів має подвійну назву.
Вивчивши закономірності фізико-хімічної вбирної здатності, К. К. Гедройц встановив: 1) катіонний обмін між твердою фазою ґрунту і розчином проходить в еквівалентних відношеннях, тобто кількість катіонів, витіснених з твердої фази і поглинених нею з розчину, еквівалентна (рівновелика); 2) обмін катіонів відбувається дуже швидко, майже миттєво; 3) реакція обміну зворотна.
Іони, що мають підвищену енергію поглинання (дво- і тривалентні), міцніше утримуються ґрунтом, ніж одновалентні. Одні і ті самі іони утримуються ґрунтом неоднаково. За М. І. Горбуновим, приблизно 80% загальної кількості катіонів утримуються відносно слабко і здатні до процесів обміну. Інші 20% міцно закріплені на поверхні колоїдів ґрунту. Іони, що розташовані на гострих і випуклих місцях поверхні колоїдних часточок, витісняються легше, ніж іони, розташовані на ввігнутих місцях або на внутрішній поверхні мікропор і міжпакетних проміжках глинистих мінералів.
Ввібрані катіони, їх кількість і співвідношення визначають багато властивостей ґрунту, тому завжди важливо знати склад увібраних катіонів, особливо наявність представників лужно-земельних і лужних елементів: Са2+, Мg2+, Nа+, К+. Для більшості ґрунтів характерними ввібраними основами є катіони Са2+ і Мg2+. Так, у більшості підтипів чорноземів ГВК насичений іонами Са2+ і Мg2+. У кислих ґрунтах у складі обмінних катіонів є водень (або алюміній), в солонцях — натрій.
Загальну кількість увібраних катіонів виражають у міліграм-еквівалентах на 100 г ґрунту і називають ємкістю катіонного обміну (ЄКО). Цю величину можна наближено розрахувати за такою формулою:
ЄКО = Са2+ + Мg2+ + Н+.
Сумарний вміст двох увібраних катіонів (кальцію і магнію) характеризується як сума обмінних основ. Вона позначається символом суми і вимірюється у міліграм-еквівалентах на 100 г ґрунту. Отже,
ЄКО = Σ + Н,
де Σ = Са2+ + Мg2+— сума двох увібраних катіонів (кальцію і магнію), мг-екв/100 г ґрунту;
Н — величина гідролітичної кислотності, мг-екв/100 г ґрунту.
Частка від ділення суми обмінних основ на ємкість катіонного обміну, виражена в процентах, характеризує ступінь насичення ґрунту основами:
V = Σ × 100/ЄКО.
К. К. Гедройц виділив ґрунти, насичені основами (в ГВК лише іони Са2+, Мg2+, К+, Na+, NH4+), і ґрунти, що ненасичені основами (в ГВК серед обмінних катіонів є іони Н+ і АІ3+).
Указані вище характеристики фізико-хімічних явищ у ґрунтах знаходять широке практичне застосування в меліорації' ґрунтів, при розрахунку доз добрив, є незамінними при науковому обґрунтуванні проведення агротехнічних та агрохімічних заходів Для підвищення родючості ґрунтів.
Під біологічною вбирною здатністю розуміють закріплення речовин у тілах організмів (рослинах, мікроорганізмах і тваринах, що живуть у ґрунті). Суттєвою особливістю біологічної вбирної здатності є поглинання живими організмами (як рослинами, так і тваринами) необхідних для їх життєдіяльності речовин. Завдяки вибірковому біологічному поглинанню у верхніх горизонтах ґрунту акумулюються необхідні для продовження життя наступних поколінь організмів макро- і мікроелементи.
Отже, вбирна здатність ґрунтів має велике значення в нагромадженні в ґрунті елементів родючості. Колоїди через фізичні властивості генетичних горизонтів визначають водний і повітряний режими ґрунтів. Від складу колоїдів та їх властивостей залежить рівень активності мікроорганізмів, а також умови росту і розвитку сільськогосподарських рослин.
Ґрунтовий розчин. Рідка фаза ґрунту є найбільш рухомою, динамічною і водночас активною його частиною. В ґрунтовому розчині мінеральні й органічні речовини знаходяться в молекулярному, колоїдному та іонному станах. У ґрунтовому розчині відбуваються процеси руйнування і синтезу гумусових речовин, формуються вторинні мінерали, утворюються органо-мінеральні сполуки. Із ґрунтового розчину рослини отримують необхідні поживні речовини і воду. В результаті того, що одні речовини можуть поглинатись рослинами, мікроорганізмами та адсорбуватись колоїдами, а інші — залишатись у ґрунтовому розчині, між рідкою і твердою фазами ґрунту встановлюється динамічна адсорбційна рівновага.
Із мінеральних сполук у ґрунтовому розчині, як правило, переважають карбонати кальцію, магнію, є нітрати, фосфати, сульфати, хлориди та солі кремнієвої кислоти. Є ґрунти, що містять у ґрунтовому розчині соду. До органічних речовин ґрунтового розчину належать гумусові кислоти та їхні солі, молекулярні розчини цукрів, амінокислот, органічних кислот тощо.
Слабкомінералізовані ґрунтові розчини характерні для тундрових, підзолистих та опідзолених ґрунтів, чорноземів та червоноземів, більш мінералізовані — для каштанових, бурих, напівпустельних і сіроземних ґрунтів, сильномінералізовані — для солончаків і солонців. При підсиханні з розчину випадають солі у вигляді кристалів.
У сільськогосподарській практиці концентрацію ґрунтового розчину вважають слабкою тоді, якщо 1 л розчину містить 0,5-2 г солей. Така концентрація характерна для ґрунтів північних областей України, що мають періодично промивний тип водного режиму. Осмотичний тиск таких розчинів коливається від 100 до 300 кПа. По мірі просування з півночі на південь концентрація ґрунтового розчину зростає і в засолених ґрунтах коливається від 5 до 100 г і більше на 1 л розчину. Осмотичний тиск розчинів досягає 1-2 МПа. На таких ґрунтах ростуть тільки солестійкі рослини, які мають високий осмотичний тиск клітинного соку.
Серед катіонів у ґрунтовому розчині знаходяться ті катіони, що входять до складу обмінних: Са2+, Мg2+, Н+, Nа+, К+, NH4+, Аl3+, Fе3+. Найважливішими аніонами ґрунтового розчину є такі: НСO3-, NO3-, Сl-, SO2-2, Н2РО4-2. Більшість з них має визначальне значення у живленні рослин. У дуже малих кількостях у ґрунтовому розчині знаходяться катіони мікроелементів: Мn2+, Zn2 + , Сu2+, Со2+ та ін.
Реакція ґрунтового розчину характеризує кислотність і лужність ґрунту. Це динамічна характеристика ґрунту, яка залежить від погодних умов, інтенсивності біологічних процесів у ґрунті, внесення добрив, агротехніки вирощування сільськогосподарської культури тощо.
Реакція розчину визначається співвідношенням у ньому іонів Н і ОН-.Відомо, що вода при 22°С розкладається на іони в кількості 1/10 000 000 моль, тобто 10-7 моль/л води. З кожної молекули води при дисоціації виділяється по одному іону Н+ і ОН-. їхня концентрація в дистильованій воді при 22°С дорівнює [Н+] = [ОН-] = 10-7 моль/л. Добуток іонів Н+ на ОН- при будь-якій концентрації має стале значення, що дорівнює 10-14. Якщо до дистильованої води прилити кислоту і тим самим збільшити в розчині концентрацію іонів Н+, то кількість іонів ОН- зменшиться настільки, на скільки збільшиться кількість іонів Н+. У зв'язку з цим реакція будь-якого розчину визначається співвідношенням у ньому іонів Н+ і ОН-. Якщо в розчині іонів Н+ > ОН-, то реакція кисла, при Н+ = ОН- — нейтральна, при Н+ < ОН- — лужна.
Реакцію ґрунтового розчину визначають через величину водневого показника (рН), що є від'ємним десятичним логарифмом концентрації іонів Н+. Якщо концентрація іонів Н+ в 1 л розчину Дорівнює 0,1 г, то рН = 1, якщо — 0,001, то рН = 3. Практично визначають рН потенціометричним способом за допомогою приладу рН-метра.
Реакція ґрунтового середовища визначає ріст і розвиток сільськогосподарських культур і є важливою умовою формування родючості ґрунту.
Кислотність ґрунту пов'язана з наявністю у ГВК і в ґрунтовому розчині катіонів Н+ або Аl3+. Розрізняють активну та потенціальну кислотності. Перша форма кислотності характерна для ґрунтового розчину, друга — для твердої фази ґрунту.
Активна, або актуальна, кислотність зумовлена наявністю в ґрунтовому розчині органічних і мінеральних кислот, що легко розчиняються у воді. У більшості ґрунтів помітне підкислення ґрунтового розчину відбувається після утворення вугільної кислоти, проте рідко зустрічається утворення в ґрунті інших мінеральних кислот. Оскільки в ґрунті постійно проходять обмінні процеси між ґрунтовим розчином і твердою фазою, то наявність іонів Н+ або Аl3+ в рідкій фазі свідчить про те, що ці катіони є і в ГВК.
Потенціальною кислотністю ґрунту називають здатність його твердої фази при обмінних реакціях виділяти в ґрунтовий розчин катіони Н- і АІ3+. Потенціальна кислотність вимірюється кількістю іонів Н+ (або Аl3+), що знаходяться у ГВК в увібраному, поглиненому стані. За певних умов ці іони можуть бути переведені в розчин; найбільш рухома частина іонів Н+ (або Аl3+) може перейти в розчин при обробці ґрунту розчином нейтральної солі, наприклад КСl, NaСl. Інша, менш рухома, частина іонів Н+ може перейти в розчин при подальшій обробці ґрунту розчином гідролітично лужної солі, наприклад СН3СООNа (її рН = 8,2).
Взаємодію ґрунту з різними солями можна записати так:
[ГВК] Н+ + НСІ ↔ [ГВК] К+ + НСl;
[ГВК] Н+ + СН3СООNa ↔ [ГВК] Na+ + СН3СООН.
У результаті обмінних реакцій катіонів солей (К+, Na+) з іонами Н+ ґрунту в сольових витяжках утворюються вільні кислоти, які можна кількісно визначити звичайним титруванням лугом. За кількістю знайденої соляної кислоти при обробці зразка ґрунту розчином нейтральної солі (КСl) визначають обмінний вид кислотності. За кількістю утвореної оцтової кислоти при обробці зразка ґрунту розчином гідролітично лужної солі (СН3СООNа) визначають гідролітичний вид кислотності ґрунту. Оскільки нейтральна сіль витісняє лише частину ввібраного водню, а гідролітичне лужна сіль — майже увесь, то найчастіше визначають величину гідролітичної кислотності, оскільки це є результуючим виразом усіх видів кислотності (рис. 2).
Хлорид алюмінію як гідролітично кисла сіль сприяє утворенню кислої реакції ґрунтового розчину.
У природі поширення кислих ґрунтів пов'язано з певними умовами ґрунтоутворення. Велике значення в утворенні ґрунтів з тією чи іншою реакцією має характер ґрунтотворної породи. Так, на карбонатних породах за однакових умов формуються ґрунти з нейтральною реакцією, що збагачені кальцієм і магнієм, а на вилугованих безкарбонатних породах формуються кислі ґрунти. Великий вплив на утворення кислих ґрунтів мають кліматичні умови. Наприклад, в умовах промивного або періодично промивного типів водного режиму ґрунтів відбувається винос солей кальцію та магнію і в ГВК поступають іони Н+. При цьому виникає явище ненасиченості ґрунту основами, тобто створюється кисла реакція. Така реакція середовища характерна для підзолистих, дерново-підзолистих, сірих лісових і опідзолених ґрунтів, червоноземів та ін. Рослинність також впливає на характер реакції ґрунту. Хвойні ліси, мох і гриби сприяють посиленню кислотності ґрунту в зв'язку з кислими властивостями їхніх органічних залишків і продуктів обміну, широколистяні ліси і трав'яниста рослинність, навпаки, сприяють нагромадженню основ у ґрунті.
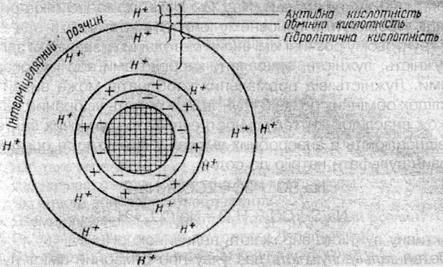
Рис. 2. Види кислотності ґрунтів
При наявності в ґрунті ввібраного алюмінію взаємодію його з розчином нейтральної солі можна записати таким рівнянням:
[ГВК]АІ3+ + 3КСl ↔ [ГВК]3К++ АlСl3.
Сільськогосподарська діяльність людини може призвести до зміни реакції ґрунту. Відчуження врожаїв з полів призводить до поступового збіднення ґрунтів елементами, в тому числі й основами. При цьому підвищується його кислотність. Крім того, підкислюють ґрунт фізіологічне кислі мінеральні добрива.
Кисла реакція ґрунтів несприятлива для більшості культурних рослин і корисних мікроорганізмів. Кислі ґрунти мають погані фізичні властивості. У зв'язку з нестачею кальцію та магнію органічна речовина в кислих ґрунтах не закріплюється і ґрунт збіднюється на поживні речовини. Основним методом підвищення продуктивності кислих ґрунтів і зменшення їхньої кислотності є вапнування.
Іншою важливою характеристикою реакції ґрунтового середовища є лужність, її наявність створює несприятливі властивості ґрунту, що призводить до пригнічення рослин і мікроорганізмів, погіршення агрофізичних властивостей ґрунтів. Розрізняють активну та потенціальну лужність.
Активна лужність зумовлена наявністю в ґрунтовому розчині гідролітично лужних солей (Na2СO3, NaНСO3, та ін.), які при дисоціації утворюють в основному іони ОН-.
У ґрунтовому розчині хімічними методами визначають загальну лужність, лужність, зумовлену карбонатами або гідрокарбонатами. Лужність від нормальних карбонатів може виявитись внаслідок обмінних реакцій ґрунтів, що містять увібраний натрій, а також внаслідок життєдіяльності сульфатредукуючих бактерій, що відновлюють в анаеробних умовах у присутності органічних речовин сульфати натрію до соди:
Na2SO4 + 2С = 2СO2 + Nа2S;
Na2S + СO2 + Н2O = Nа2СO3 + Н2S.
Активну лужність виражають величиною рН. Потенціальна лужність дає уяву про сумарний вміст лугів у ґрунтовому розчині і ГВК. Потенціальна лужність виявляється у і ґрунтів, що містять увібраний натрій. При взаємодії такого ґрунту з вугільною кислотою, що знаходиться в ґрунтовому розчині, відбувається реакція заміщення, результатом якої є нагромадження соди і підлуження розчину:
[ГВК]2Na++Н2СO3 ↔ [ГВК]2Н+ + Nа2СO3.
Потенціальну лужність виражають у міліграм-еквівалентах на 100 г ґрунту. Лужність ґрунтового розчину культурні рослини переносять гірше, ніж кислотність. Найбільш токсичним є карбонат натрію. Його шкідливий вплив починає виявлятись при вмісті іонів СO3-2 у кількості 0,005-0,02%, або 0,17-0,7 мг-екв на 100 г ґрунту. Гідрокарбонат натрію менш токсичний. Його шкідливий вплив починає виявлятись при вмісті іонів НСO3- у кількості 0,065-0,4%, або 1,0-6,25 мг-екв на 100 г ґрунту.
Надлишкову лужність ліквідовують внесенням фізіологічно кислих мінеральних добрив, гною і гіпсу.
Буферність ґрунту — це його здатність протидіяти зміні реакції ґрунтового розчину. Чим більша буферність ґрунту, тим важче змінити його реакцію в кислий або лужний бік. Буферність ґрунту залежить від його гранулометричного складу. Високу буферність мають важкі високогумусовані ґрунти. На буферність впливає кількісний і якісний склад обмінних катіонів ґрунту, величина ємкості катіонного обміну.
Буферна здатність є одним із елементів родючості ґрунтів. Вона дає змогу зберегти сприятливі для рослин властивості ґрунтів. Буферність ґрунту необхідно враховувати при проведенні хімічної меліорації — вапнуванні та гіпсуванні.
Контрольні запитання
1. Що таке колоїди?
2. Які властивості ґрунтових колоїдів?
3. Що таке міцела?
4. Що називають ґрунтовим вбирним комплексом?
5. Які є види вбирної здатності ґрунтів?
6. Якими показниками характеризується ґрунтовий розчин?
7. Як визначається реакція ґрунтового середовища?
8. Що таке кислотність і які види кислотності ґрунту?
9. Що таке лужність ґрунту та її види?
10.Що таке буферність ґрунту?






