S2– + НОН «... + ОН–:
а) HS–;
б) H2S;
в) SO32–;
г) S2–;
д) Na+.
116. Ступінь гідролізу розраховують за формулою:

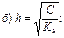
в) h = CKh;

д) h = С – Kh.
117. Ступінь гідролізу натрій гіпохлориту в 0,05 М розчині (Kд HClO = 2,95 × 10–8) дорівнює:
а) 2,6 × 10–3;
б) 8,6 × 10–3;
в) 3,4 × 10–4;
г) 5,8 × 10–5;
д) 8,2 × 10–5.
118. Ступінь гідролізу калій ціаніду в 0,1 М розчині (Kд HCN = 5 × 10–10) дорівнює:
а) 1,4 × 10–2;
б) 1,3 × 10–6;
в) 1,4 × 10–5;
г) 1,2 × 10–3;
д) 1,6 × 10–5.
119. Ступінь гідролізу амоній броміду в 0,1 М розчині (Kд NH4OH = 1,76 × 10–5) дорівнює:
а) 7,5 × 10–5;
б) 5,6 × 10–10;
в) 2,8 × 10–7;
г) 1,5 × 10–5;
д) 4,9 × 10–11.
120. Ступінь гідролізу натрій нітриту в 0,05 М розчині (Kд HNO2 = 5 × 10–4) дорівнює:
а) 1,4 × 10–5;
б) 10–6;
в) 1,9 × 10–3;
г) 2 × 10–6;
д) 10–4.
121. Ступінь гідролізу калій ціаніду в 1 М розчині (Kд HCN = 5 × 10–10) дорівнює:
а) 4,4 × 10–3;
б) 1,6 × 10–5;
в) 3,9 × 10–5;
г) 4,5 × 10–4;
д) 2,7 × 10–3.
122. Константа гідролізу солі, утвореної слабкою кислотою та сильною основою, має вираз:





123. Константа гідролізу солі, утвореної слабкою основою та сильною кислотою, має вираз:


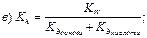


 |
124. Указати, для якої з наведених солей відповідає вираз константи гідролізу:
а) NH4Cl;
б) Na2CO3;
в) K3PO4;
г) K2SO4;
д) Ba(NO3)2.
 |
125. Указати, для якої з наведених солей відповідає вираз константи гідролізу:
а) K2SO3;
б) Al2(SO4)3;
в) NH4CN;
г) K2SO4;
д) Fe(NO3)2.
 |
126. Указати, для якої з наведених солей відповідає вираз константи гідролізу:
а) NaCN;
б) (NH4)2SO4;
в) CH3COONH4;
г) (NH4)3PO4;
д) Na2SO4.
 |
127. Указати, для якої з наведених солей відповідає вираз константи гідролізу:
а) Zn(NO3)2;
б) KCl;
в) Ba(NO3)2;
г) (CH3COO)2Pb;
д) Na2SO4.
128. Константа гідролізу калій сульфіту за першим ступенем (Kд H2SO3 = 6,3 × 10–8) дорівнює:
а) 1,58 × 10–7;
б) 5,9 × 10–12;
в) 4,26 × 10–10;
г) 5,88 × 10–14;
д) 3,17 × 10–8.
129. Константа гідролізу натрій нітриту (Kд HNO2 = 5 × 10–4) дорівнює:
а) 2 × 10–11;
б) 2 × 10–9;
в) 3 × 10–12;
г) 5 × 10–18;
д) 4 × 10–6.
130. У результаті гідролізу калій сульфіту за першим ступенем утворюється:
а) сильна основа, рН > 7;
б) сильна кислота, рН > 7;
в) слабка основа, рН < 7;
г) сильна кислота, рН < 7;
д) сильна основа, рН < 7.
131. У результаті гідролізу NH4NO3 утворюється:
а) сильна кислота, рН < 7;
б) слабка основа, рН > 7;
в) сильна основа, рН > 7;
г) сильна кислота, рН > 7;
д) слабка кислота, рН < 7.
132. При гідролізі солі SnCl2 за першим ступенем утворюється:
а) основна сіль, рН < 7;
б) кисла сіль, рН > 7;
в) основна сіль, рН > 7;
г) слабка кислота, рН > 7;
д) кисла сіль, рН < 7.
133. При гідролізі солі Zn(NO3)2 за першим ступенем утворюється:
а) основна сіль, рН < 7;
б) кисла сіль, рН > 7;
в) основна сіль, рН > 7;
г) основна сіль, рН = 7;
д) кисла сіль, рН < 7.
134. При гідролізі натрій ацетату утворюється:
а) слабка кислота, рН > 7;
б) сильна основа, рН < 7;
в) слабка кислота, рН < 7;
г) слабка основа, рН > 7;
д) сильна кислота, рН > 7.
135. У водному розчині середовище з рН < 7 утворює сіль:
а) магній (ІІ) хлорид;
б) натрій нітрат;
в) калій сульфіт;
г) натрій нітрит;
д) калій сульфат.
136. У водному розчині середовище з рН > 7 утворює сіль:
а) натрій карбонат;
б) натрій хлорид;
в) купрум (ІІ) сульфат;
г) амоній сульфат;
д) ферум (ІІІ) нітрат.
137. У водному розчині середовище з рН > 7 утворює сіль:
а) калій сульфід;
б) калій сульфат;
в) натрій бромід;
г) натрій нітрат;
д) ферум (ІІІ) хлорид.
138. У водному розчині середовище з рН > 7 утворює сіль:
а) калій о -фосфат;
б) калій нітрат;
в) натрій сульфат;
г) калій йодид;
д) калій бромід.
139. У водному розчині середовище з рН < 7 утворює сіль:
а) алюміній (ІІІ) нітрат;
б) калій сульфід;
в) барій (ІІ) нітрат;
г) натрій хлорид;
д) натрій карбонат.
140. Молекулярному рівнянню реакції гідролізу NH4HCO3 + HOH «NH4OH + H2CO3 відповідає іонне рівняння:
а) NH4+ + HCO3– + HOH «H2CO3 + NH4+ + OH–;
б) NH4+ + HOH «H+ + NH4OH;
в) HCO3– + HOH «H2CO3 + OH–;
г) NH4+ + HCO3– + HOH «H2CO3 + NH4OH;
д) HCO3– + HOH «H2CO3 + H+.
141. Іонно-молекулярному рівнянню реакції гідролізу HCO3– + HOH «OH– + H2CO3 відповідає молекулярне рівняння:
а) NaHCO3 + HOH «NaOH + H2CO3;
б) Fe(HCO3)3 + HOH «Fe(OH)2 + H2CO3;
в) NH4HCO3 + HOH «NH4OH + H2CO3;
г) K2CO3 + HOH «KHCO3 + KOH;
д) Zn(HCO3)2 + HOH «Zn(OH)2 + H2CO3.
142. Процесу гідролізу натрій карбонату у водному розчині відповідає іонне рівняння:
а) CO32– + H2O «HCO3– + OH–;
б) Na2CO3 + HOH «NaOH + NaHCO3;
в) Na+ + HOH «NaOH + H+;
г) HCO3– + HOH «H2CO3 + OH–;
д) Na2CO3 «2Na+ + CO32–.
143. Взаємодії водних розчинів калій гідрогенкарбонату та калій гідроксиду відповідає іонне рівняння:
а) HCO3– + OH– «CO32– + H2O;
б) CO32– + 2H+ «CO2 + H2O;
в) KHCO3 + OH– «K+ + CO32– + H2O;
г) H+ + OH– «H2O;
д) HCO3– + H+ «CO32– + H2O.
144. Іонному рівнянню S2– + HOH «HS– + OH– відповідає гідроліз солі:
а) калій сульфіду;
б) амоній сульфіду;
в) калій сульфіту;
г) натрій гідрогенсульфіду;
д) калій сульфату.
145. Збільшення концентрації гідроген(+1)-іонів у водному розчині відбувається при гідролізі солі:
а) хром (ІІІ) нітрату;
б) калій нітриту;
в) купрум (ІІ) ацетату;
г) калій сульфату;
д) натрій сульфіту.
146. Збільшення концентрації гідроксид-іонів відбувається в результаті гідролізу солі:
а) Na2SО3;
б) NaCl;
в) CrCl3;
г) Fe2(SO4)3;
д) Na2SO4.
147. Концентрація ОН–-іонів у водному розчині збільшується при гідролізі солі:
а) натрій сульфіду;
б) хром (ІІІ) хлориду;
в) ферум (ІІІ) сульфату;
г) станум (ІІ) хлориду;
д) калій сульфату.
148. Концентрація гідроген(+1)-іонів найбільша у водному розчині солі:
а) алюміній (ІІІ) хлориду;
б) барій (ІІ) хлориду;
в) натрій хлориду;
г) калій ацетату;
д) кальцій (ІІ) нітрату.
149. Збільшення концентрації гідроксид-іонів відбувається в результаті гідролізу солі:
а) натрій сульфіду;
б) хром (ІІІ) хлориду;
в) натрій хлориду;
г) ферум (ІІІ) сульфату;
д) натрій сульфату.
150. Сильна кислота утворюється при гідролізі солі:
а) CuCl2;
б) Na2SO4;
в) NaNO2;
г) KCN;
д) NaNO3.
151. Сильна кислота утворюється при гідролізі солі:
а) MgSO4;
б) KCN;
в) NaBr;
г) NaNO2;
д) Fe(NO3)3.
152. Слабка кислота утворюється при гідролізі солі:
а) Na2SO3;
б) K2SO4;
в) Al2(SO4)3;
г) Ba(NO3)2;
д) Fe(NO3)2.
153. Слабка кислота утворюється при гідролізі солі:
а) калій ацетату;
б) магній (ІІ) хлориду;
в) алюміній (ІІІ) сульфату;
г) натрій o -фосфату;
д) ферум (ІІІ) нітрату.
154. Слабка кислота утворюється при гідролізі солі:
а) натрій ціаніду;
б) барій (ІІ) хлориду;
в) натрій сульфату;
г) купрум (ІІ) сульфату;
д) натрій нітрату.
155. Гідроксосіль утворюється в результаті гідролізу:
а) алюміній (ІІІ) сульфату;
б) калій сульфіду;
в) калій хлориду;
г) алюміній (ІІІ) сульфіду;
д) калій сульфіту.
156. Гідроксосіль утворюється при гідролізі солі:
а) алюміній (ІІІ) сульфату;
б) алюміній (ІІІ) сульфіду;
в) калій сульфіту;
г) калій хлориду;
д) калій сульфіду.
157. Гідроксосіль утворюється при гідролізі солі:
а) Fe(NO3)2;
б) K2CO3;
в) Na2SO4;
г) NH4Cl;
д) Na2S.
158. Гідроксосіль утворюється при гідролізі солі:
а) нікель (ІІ) нітрату;
б) барій (ІІ) хлориду;
в) калій сульфіду;
г) натрій хлориду;
д) амоній сульфату.
159. Кисла сіль утворюється при гідролізі солі, яка утворена:
а) слабкою багатоосновною кислотою та сильною основою;
б) сильною кислотою та слабкою основою;
в) слабкою багатоосновною кислотою та слабкою основою;
г) сильною кислотою та сильною основою;
д) слабкою багатокислотною основою та слабкою кислотою.
160. При гідролізі солі натрій сульфіду за першим ступенем утворюється:
а) кисла сіль + основа;
б) основна сіль + кислота;
в) кисла сіль + кислота;
г) кисла сіль + основна сіль;
д) основна сіль + основа.
161. При гідролізі солі алюміній (ІІІ) хлориду за першим ступенем утворюється:
а) основна сіль + кислота;
б) кисла сіль + основа;
в) кисла сіль + основна сіль;
г) основна сіль + основа;
д) кисла сіль + кислота.
162. У результаті гідролізу солі ферум (ІІ) сульфату за першим ступенем утворюється:
а) основна сіль + кислота;
б) основна сіль;
в) кисла сіль + кислота;
г) кисла сіль;
д) кисла сіль + основа.
163. У результаті гідролізу солі алюміній (ІІІ) сульфату за першим ступенем утворюється:
а) основна сіль + кислота;
б) основна сіль;
в) кисла сіль + основа;
г) кисла сіль + кислота;
д) кисла сіль.
164. При гідролізі солі натрій карбонату за першим ступенем утворюється:
а) кисла сіль + основа;
б) основна сіль + кислота;
в) кисла сіль + кислота;
г) кисла сіль + основна сіль;
д) основна сіль + основа.
165. Значення рН 1,5 М розчину форміатної кислоти (Kд НСООН = 1,8 × 10–4) дорівнює:
а) 1,8;
б) 1,1;
в) 0,9;
г) 3,4;
д) 2,8.
166. Значення рН 0,18 М розчину амоній хлориду (Kд NH4OH = 1,76 × 10–5) дорівнює:
а) 5;
б) 9;
в) 4;
г) 8;
д) 6.
167. Значення рН 0,05 М розчину натрій гіпохлориту (Kд HClO = 2,95 × 10–8) дорівнює:
а) 10,1;
б) 8,1;
в) 4,2;
г) 12,7;
д) 11,3.
168. рН 0,4 М розчину кобальт (ІІ) сульфату з урахуванням гідролізу солі за першим ступенем (Kд СоОН+ = 4 × 10–5) дорівнює:
а) 4;
б) 5;
в) 10;
г) 2;
д) 7.
169. При взаємодії водних розчинів Cr2(SO4)3 та Na2CO3 утворюється осад:
а) Cr(OH)3;
б) Cr(HCO3)2;
в) Cr2(CO3)3;
г) CrOHCO3;
д) Cr(OH)2CO3.
170. У результаті реакції, яка перебігає за рівнянням Cr2(SO4)3 + Na2CO3 + H2O ®..., утворюється осад:
а) Cr(OH)3;
б) Cr(HCO3)3;
в) (CrOH)2SO4;
г) Cr2(CO3)3;
д) (CrOH)2CO3.
171. У результаті взаємодії водних розчинів хром (ІІІ) хлориду та натрій сульфіду утворюється осад:
а) Cr(OH)3;
б) Cr(HS)3;
в) CrOHS;
г) Cr2S3;
д) Cr2(SO3)3.
172. При взаємодії водних розчинів купрум (ІІ) сульфату та натрій карбонату утворюється сполука:
а) купрум (ІІ) гідроксокарбонат;
б) купрум (ІІ) карбонат;
в) купрум (ІІ) гідроксосульфат;
г) купрум (ІІ) гідроксид;
д) купрум (ІІ) гідрогенкарбонат.
173. У результаті реакції, яка перебігає за рівнянням AlCl3 + Na2SO3 + H2O ®..., утворюється осад:
а) алюміній (ІІІ) гідроксиду;
б) алюміній (ІІІ) сульфіду;
в) алюміній (ІІІ) гідроксосульфіту;
г) алюміній (ІІІ) сульфіту;
д) алюміній (ІІІ) гідрогенсульфіту.
174. Буферні розчини – це:
а) розчини, які зберігають постійне значення рН при додаванні кислот та лугів або при зміні концентрації;
б) розчини, які зберігають постійне значення рН при додаванні кислот та лугів;
в) розчини, які мають постійне значення рН при зміні концентрації;
г) розчини, які зберігають постійне значення рН при додаванні кислот;
д) розчини, які мають постійне значення рН при зміні температури та концентрації.
175. До складу буферної системи входять такі компоненти:
а) сіль слабкої кислоти і сильної основи та слабка кислота;
б) слабка кислота та сильна основа;
в) сіль слабкої кислоти і сильної основи та сильна кислота;
г) сіль сильної кислоти і сильної основи та слабка кислота;
д) сильна кислота та слабка основа.
176. Указати, у якому випадку рН буферної системи буде дорівнювати р K:
а) при рівній кількості кислоти та солі;
б) при двократному об’ємі кислоти;
в) при рівних об’ємах та різних концентраціях кислоти та солі;
г) при різних об’ємах кислоти та солі з однаковими молярними концентраціями;
д) при збільшенні концентрації солі вдвічі.
177. Буферна ємність – це кількість моль-екв сильної кислоти або основи, яку необхідно додати до:
а) 1 л буферної системи, щоб змінити рН на 1;
б) буферної системи, щоб зафіксувати зміну рН;
в) 1 мл буферної системи, щоб змінити рН на 1;
г) 1 л буферної системи, щоб зміна рН не відбулася;
д) 10 л буферної системи, щоб змінити рН на 1.
178. Буферна ємність – це кількість моль-екв сильної кислоти або основи, яку необхідно додати до 1 л буферної системи, щоб змінити рН на:
а) 1;
б) 0,1;
в) 2;
г) 10;
д) 0,01.
179. Буферна ємність залежить від:
а) концентрації та співвідношення компонентів системи;
б) молярної концентрації кислоти;
в) рН розчину кислоти;
г) молярної концентрації солі;
д) рН розчину солі.
180. Указати склад буферних систем основного типу:
а) слабка основа + сіль, яка утворена сильною кислотою;
б) сильна кислота + сіль, яка утворена слабкою основою;
в) слабка основа + сіль, яка утворена слабкою кислотою;
г) сильна основа + сильна кислота;
д) сильна кислота + слабка основа.
181. Указати склад фосфатного буферу:
а) Na2HPO4 + NaH2PO4;
б) Na3PO4 + NaH2PO4;
в) Na3PO4 + H3PO3;
г) Na2HPO4 + NaOH;
д) NaH2PO4 + H3PO4.
182. Указати склад амоніачного буферу:
а) NH4OH + NH4Cl;
б) NH4NO3 + HNO3;
в) NH4OH + HCl;
г) NH4Cl + HCl;
д) NH4NO3 + NH4Cl.
183. Фосфатний буфер складається з:
а) натрій дигідрогенфосфат + натрій гідрогенфосфат;
б) о -фосфатна кислота + натрій о -фосфат;
в) натрій дигідрогенфосфат + натрій о -фосфат;
г) о -фосфатна кислота + натрій гідрогенфосфат;
д) о -фосфатна кислота + натрій дигідрогенфосфат.
184. Указати склад ацетатного буферу:
а) CH3COOH + CH3COONa;
б) CH3COOH + NaOH;
в) CH3COOH + HCOONa;
г) CH3COOH + CH3COOCH3;
д) CH3OH + CH3COOH.
185. Концентрацію гідроген(+1)-іонів для буферної системи кислотного типу розраховують за рівнянням:

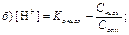



186. Концентрацію гідроксид-іонів для буферної системи основного типу розраховують за рівнянням:


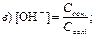
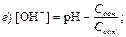

187. Указати рівняння Гендерсона–Гассельбаха для обчислення рН кислотної буферної системи:



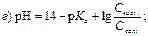

188. рН ацетатної буферної системи розраховують за рівнянням:

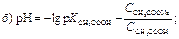

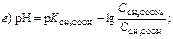
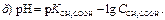
189. Указати рівняння Гендерсона–Гассельбаха для обчислення рН основної буферної системи:





190. Рівняння Гендерсона–Гассельбаха для фосфатного буферу має вигляд:




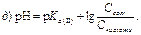
191. Кислотно-основний стан організму оцінюють за допомогою рівняння Гендерсона–Гассельбаха, виведеного для:


 |


192. Кислотно-основна рівновага в організмі людини – це сталість величини:
а) рН;
б) осмотичного тиску;
в) в’язкості крові;
г) температури;
д) артеріального тиску.
193. рН крові в нормі становить:
а) 7,36;
б) 1,86;
в) 4,38;
г) 6,06;
д) 8,52.
194. рН венозної крові:
а) менше за рН артеріальної крові;
б) однаковий з рН артеріальної крові;
в) не можна порівнювати з рН артеріальної крові;
г) більше за рН артеріальної крові;
д) є частиною рН артеріальної крові.
195. рН шлункового соку (у нормі) становить:
а) 0,9–1,6;
б) 5,6–7,9;
в) 3,1–4,4;
г) 7,1–7,4;
д) 8,6–9,0.
196. рН сечі (у нормі) становить:
а) 5,3–6,5;
б) 8,2–10,1;
в) 1,4–4,4;
г) 3,2–4,3;
д) 6,7–9,3.
197. Ацидоз – це:
а) зміщення рН крові у кислий бік;
б) наближення рН крові до нормального фізіологічного стану;
в) гранична концентрація гідроксид-іонів у крові;
г) зміщення рН крові в лужний бік;
д) рівноважний кислотно-основний стан.
198. Алкалоз – це:
а) зміщення рН крові в лужний бік;
б) рівноважний кислотно-основний стан;
в) зміщення рН крові у кислий бік;
г) гранична концентрація гідроген(+1)-іонів у крові;
д) наближення рН крові до нормального фізіологічного стану.
199. До причин метаболічного ацидозу не належить:
а) втрата Н+-іонів при блювоті та кишковій непрохідності;
б) втрата НСО3–-іонів при колітах та виразках;
в) утворення стійких органічних кислот, наприклад, кетокислот при цукровому діабеті;
г) кисневе голодування тканин;
д) неповне видалення кислот із організму при нирковій недостатності.
200. До причин дихального ацидозу належить:
а) порушення регуляції дихання при травмах та пухлинах мозку;
б) стан лихоманки;
в) тривалий прийом лужних мінеральних вод;
г) неповне видалення кислот із організму при нирковій недостатності;
д) кисневе голодування тканин.
201. До причин метаболічного алкалозу не належить:
а) втрата НСО3–-іонів при колітах та виразках;
б) збільшення концентрації НСО3–-іонів при введенні солей органічних кислот;
в) тривалий прийом лужної їжі;
г) втрата Н+-іонів при блювоті та кишковій непрохідності;
д) тривалий прийом лужної мінеральної води.
202. До причин дихального алкалозу належить:
а) вдихання розрядженого повітря;
б) втрата Н+-іонів при блювоті та кишковій непрохідності;
в) кисневе голодування тканин;
г) отруєння алкоголем;
д) порушення регуляції дихання при травмах та пухлинах мозку.
203. Метаболічний ацидоз – це:
а) надлишок карбон (IV) оксиду або недолік НСО3–-іонів у міжклітинній рідині;
б) сталість внутрішнього середовища організму;
в) зниження вентиляції легень у порівнянні з нормою;
г) видалення кислот із організму та накопичення НСО3–-іонів у міжклітинній рідині;
д) підвищення вентиляції легень у порівнянні з нормою.
204. Дихальний ацидоз – це:
а) зниження вентиляції легень у порівнянні з нормою;
б) видалення кислот із організму та накопичення НСО3–-іонів у міжклітинній рідині;
в) сталість внутрішнього середовища організму;
г) підвищення вентиляції легень у порівнянні з нормою;
д) надлишок карбон (IV) оксиду або недолік НСО3–-іонів у міжклітинній рідині.
205. Метаболічний алкалоз – це:
а) видалення кислот із організму та накопичення НСО3–-іонів у міжклітинній рідині;
б) підвищення вентиляції легень у порівнянні з нормою;
в) надлишок карбон (IV) оксиду або недолік НСО3–-іонів у міжклітинній рідині;
г) зниження вентиляції легень у порівнянні з нормою;
д) сталість внутрішнього середовища організму.
206. Дихальний алкалоз – це:
а) підвищення вентиляції легень у порівнянні з нормою;
б) сталість внутрішнього середовища організму;
в) надлишок карбон (IV) оксиду або недолік НСО3–-іонів у міжклітинній рідині;
г) зниження вентиляції легень у порівнянні з нормою;
д) видалення кислот із організму та накопичення НСО3–-іонів у міжклітинній рідині.






