¬ещества, водные растворы которых провод€т электрический ток, называютс€ электролитами. ¬ отличие от металлов, имеющих электронную проводимость и полупроводников, имеющих электронно-дырочную проводимость, электролиты обладают ионной проводимостью.
»ногда электролитами называют и сами провод€щие растворы, хот€ более правильное выражение Ц раствор электролита.
ћолекулы воды в незначительной степени распадаютс€ на ионы:
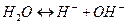 . (1)
. (1)
онцентраци€ ионов водорода определ€ет кислотность раствора, а концентраци€ ионов гидроксила характеризует щелочность раствора. ¬ чистой воде концентрации ионов Ќ + и ќЌ - равны. „иста€ вода диссоциирует очень слабо. ¬ 1 моль воды при 22º — распадаетс€ на ионы всего 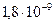 моль.
моль.
ќднако получить такую воду очень трудно, т.к. в воздухе всегда присутствует углекислый газ, который, раствор€€сь воде, увеличивает концентрацию водородных ионов. “ак как вода имеет большую диэлектрическую проницаемость (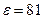 ) и молекулы воды обладают значительным дипольным моментом (
) и молекулы воды обладают значительным дипольным моментом (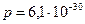 л∙м), то вокруг молекул воды на межатомных рассто€ни€х (
л∙м), то вокруг молекул воды на межатомных рассто€ни€х ( нм) существует довольно сильное электрическое поле. ѕоследнее €вл€етс€ непосредственной причиной, ослабл€ющей силу электростатического прит€жени€ ионов в молекулах растворенного вещества. ѕоэтому в процессе растворени€ соли или щелочи за счет тепловых соударений происходит распад молекул на анионы и катионы. ≈сли молекулы растворенного вещества в воде не диссоциируют на ионы, то раствор не €вл€етс€ проводником. Ќапример, водные растворы сахаров, глицерина Ц изол€торы.
нм) существует довольно сильное электрическое поле. ѕоследнее €вл€етс€ непосредственной причиной, ослабл€ющей силу электростатического прит€жени€ ионов в молекулах растворенного вещества. ѕоэтому в процессе растворени€ соли или щелочи за счет тепловых соударений происходит распад молекул на анионы и катионы. ≈сли молекулы растворенного вещества в воде не диссоциируют на ионы, то раствор не €вл€етс€ проводником. Ќапример, водные растворы сахаров, глицерина Ц изол€торы.
–езультатом диссоциации €вл€етс€ образование сольватов (гидратов), когда молекулы воды Ђобволакиваютї ионы, образу€ вокруг них сольватную оболочку (рисунок 1).

–исунок 1 —ольватные оболочки: а Ц катиона; б Ц аниона
ƒл€ возникновени€ электрического тока в электролите, необходимо в ванну с раствором электролита опустить электроды из провод€щего материала (металл, уголь и т.п.), к которым подключить источник тока (рисунок 2). “акое устройство называетс€ гальванической или электролитической ванной.
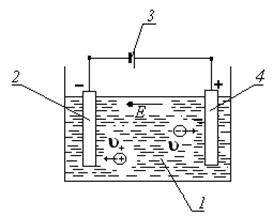
–исунок 2 Ёлектролитическа€ ванна: 1 - ванна с раствором
медного купороса; 2 - катод; 3 Ц источник тока; 4 Ц анод;
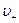 и
и  - скорости положительных и отрицательных ионов
- скорости положительных и отрицательных ионов
Ќа ион в электролите действуют две силы: сила со стороны электрического пол€  и сила сопротивлени€ движению со стороны среды
и сила сопротивлени€ движению со стороны среды 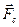 . —ила, действующа€ со стороны электрического пол€, вычисл€етс€ по формуле:
. —ила, действующа€ со стороны электрического пол€, вычисл€етс€ по формуле:
 , (2)
, (2)
где  - зар€д иона, л;
- зар€д иона, л; 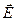 - напр€женность электрического пол€,
- напр€женность электрического пол€,  .
.
—ила 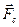 , обусловленна€ взаимодействием молекул, окружающих ион, пропорциональна скорости
, обусловленна€ взаимодействием молекул, окружающих ион, пропорциональна скорости  :
:
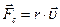 , (3)
, (3)
где  - коэффициент сопротивлени€ движению ионов в среде.
- коэффициент сопротивлени€ движению ионов в среде.
ѕри движении иона в электролите между силами быстро устанавливаетс€ равновесие и движение иона между электродами можно рассматривать как равномерное и пр€молинейное, поэтому:
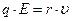 . (4)
. (4)
»з (4) следует:
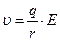 . (5)
. (5)
≈сли обозначить 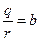 , то
, то 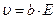 . оэффициент b называетс€ подвижностью ионов. ‘изический смысл подвижности в том, что она характеризует скорость ионов в электролите при напр€женности электрического пол€ ≈ = 1
. оэффициент b называетс€ подвижностью ионов. ‘изический смысл подвижности в том, что она характеризует скорость ионов в электролите при напр€женности электрического пол€ ≈ = 1  .
.
|
|
|
“ак как ток в электролитах представл€ет собой упор€доченное движение ионов обоих знаков, обусловленное действием внешнего электрического пол€, то плотность тока в электролите определ€етс€ выражением:
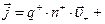
 , (6)
, (6)
где n + и  - - концентрации катионов и анионов;
- - концентрации катионов и анионов;  + и
+ и  -- - скорости их дрейфа,
-- - скорости их дрейфа,  + и
+ и  - - их зар€ды.
- - их зар€ды.
ѕроисход€щие на катоде и на аноде окислительно-восстанови-тельные реакции подчин€ютс€ законам ‘араде€.
ѕервый закон: масса выделившегос€ на электроде вещества пропорциональна протекшему через электролит зар€ду:
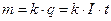 , (7)
, (7)
где  - электрохимический эквивалент; I Ц сила тока, ј; t - врем€, с.
- электрохимический эквивалент; I Ц сила тока, ј; t - врем€, с.
Ёлектрохимические эквиваленты р€да элементов приведены в таблице 1.
“аблица 1 «начени€ электрохимических эквивалентов
дл€ некоторых веществ
| ¬ещество | јтомна€ масса, а.е.м | ¬алентность | Ёлектрохимический эквивалент, кг/ л |
| —еребро | 107,9 | 1 | 1,118×10-6 |
| ћедь | 63,6 | 2 | 3,249×10-7 |
| ÷инк | 65,37 | 2 | 3,281×10-7 |
| ¬одород | 1,006 | 1 | 1,045×10-8 |
| ислород | 16,00 | 2 | 0,829×10-7 |
| ’лор | 35,46 | 3,674×10-7 |
¬торой закон: электрохимические эквиваленты элементов пр€мо пропорциональны их химическим эквивалентам:
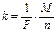 , (8)
, (8)
где F - число ‘араде€ (F= 96500 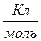 ); M Ц мол€рна€ масса выделившегос€ на электроде вещества; n Ц его валентность,
); M Ц мол€рна€ масса выделившегос€ на электроде вещества; n Ц его валентность,  - химический эквивалент.
- химический эквивалент.
ѕродукты электровосстановлени€ или электроокислени€ ионов электролита могут вступить в химические реакции с раствором вблизи электрода. “акие процессы называютс€ вторичными реакци€ми.
¬се эти процессы наход€т применение в различных отрасл€х техники, многие из них используютс€ также в медицине.






