В пластовых условиях газы в зависимости от их состава, давления и температуры (термобарического режима в пласте) могут находиться в различных агрегатных состояниях – газообразном, жидком, в виде газожидкостных смесей.
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (УВ) метанового ряда СН4-С4Н10: метана, этана, пропана, изобутана и н-бутана, а также неуглеводородных компонентов: H2S, N2, CO, CO2, H2, Ar, He, Kr, Xe и других.
Состав газовых смесей выражается в виде массовой или объемной концентрации компонентов в процентах и мольных долях:
 , (4.1)
, (4.1)
где Ni - масса i-го компонента;
Σ Ni - суммарная масса смеси.
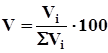 , (4.2)
, (4.2)
где Vi - объем i-го компонента в смеси;
Σ Vi - суммарный объем газа.
 , (4.3)
, (4.3)
где ni - число молей i-го компонента в смеси;
Σ ni - суммарное число молей газа в системе.
Уравнение состояния Клапейрона–Менделеева связывает давление, температуру и объем газа, представленного в виде физически однородной системы, при условиях термодинамического равновесия.
 , (4.4)
, (4.4)
где Р – давление, Па;
V – объем газа, м3;
G – масса газа, кг;
R – газовая постоянная, Дж/(кг • К);
T – абсолютная температура, К.
Газовая постоянная R численно равна работе расширения 1 кг идеального газа в изобарическом процессе при увеличении температуры газа на 1 К.
Уравнение состояния Клапейрона–Менделеева справедливо для идеального газа и для нефтяных систем работает в области давлений, близких к атмосферному. При давлениях Р > 10 атм нефтяной газ из идеальной системы переходит в неидеальную и описывается уравнением Клайперона-Менделеева с коэффициентом сжимаемости z, который учитывает отклонение реальных газов от законов сжатия и расширения идеальных газов.
Ниже записано уравнение состояния смеси газов в пластовых условиях, выраженное через мольные доли компонентов:
 . (4.5)
. (4.5)
Коэффициент сжимаемости газа z функционально зависит от приведенных давлений и температур, z = f (Tприв, Рприв).
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
Критическая температура (Ткр) – максимальная температура, при которой свойства газовой и жидкой фаз находятся в равновесии.
Критическое давление (Ркр) – давление паров вещества при критической температуре.
Среднекритические (псевдокритические) параметры смеси газов определяются по правилу аддитивности:
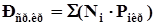 , (4.6)
, (4.6)
 . (4.7)
. (4.7)
Приведенными параметрамисмеси газов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа: температура, давление, объем, плотность и другие больше или меньше среднекритических.
 , (4.8)
, (4.8)
 . (4.9)
. (4.9)
В соответствии с законом Авогадро один моль газа занимает объем при нормальных условиях 22,414 л, а при стандартных условиях 24,055л.
Нормальным условиям (н.у.) соответствуют абсолютная температура 273,15 К и абсолютное давление 0,1 МПа.
Стандартным условиям (с.у.) соответствуют температура 20°С (293,15 К) и абсолютное давление 0,1 МПа.
Объем газа в пластовых условиях определяется из соотношения Бойля-Мариотта:
 , (4.10)
, (4.10)
 , (4.11)
, (4.11)
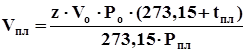 . (4.12)
. (4.12)
Объемный коэффициент газа оценивается отношением объема газа в пластовых условиях к объему, занимаемому газом при н.у.:
 , (4.13)
, (4.13)
 . (4.14)
. (4.14)






