
9.6. Восстановление карбоновых кислот и их функциональных производных
Для восстановления карбоновых кислот до спиртов используют алюмогидрид лития:
 |
Восстановление сложных эфиров сопровождается их расщеплением и образованием двух спиртов: спирта, эфиром которого он является, и первичного спирта, соответствующего кислотному остатку эфира:
 |
этилпальмитат гексадеканол-1 этанол
При восстановлении амидов кислот получают первичные амины:
 |
ацетамид этиламин
Каталитическое гидрирование нитрилов приводит к образованию первичных аминов:
 |
нитрил первичный амин
9.7. Восстановление нитросоединений
Восстановление нитросоединений алифатического и ароматического ряда, подобно другим органическим соединениям, можно проводить двумя способами: каталитическим гидрированием молекулярным водородом, а также используя металл в сочетании с кислотами, например, железо, соляную или серную кислоты, олово и соляную кислоту, или сероводород, сульфиды щелочных металлов.
Из-за сравнительно малой доступности алифатических нитросоединений реакция, идущая по схеме:
 имеет ограниченное применение.
имеет ограниченное применение.
Восстановление ароматических нитросоединений – это наиболее распространенный способ получения первичных аминов:
 |
нитробензол анилин
Следует отметить, что ароматические амины являются конечным продуктом восстановления нитросоединений, которые в зависимости от природы восстановителя и среды, в которой ведут реакцию, дают ряд других ароматических соединений азота.
В кислой среде (HCl) конечным продуктом восстановления нитробензола является анилин в виде его соли. Реакция идет через следующие стадии:

нитробензол нитрозобензол фенилгидрок- солянокислый
силамин анилин
Восстановление нитробензола в щелочной среде приводит еще к трем продуктам:

10. Реакции поликонденсации
Если молекула органического соединения содержит две функциональные группы, она способна взаимодействовать с другим бифункциональным соединением. В результате последовательных реакций образуется полимер.
Поликонденсация – это процесс взаимодействия бифункциональных молекул мономера, часто сопровождающийся отщеплением низкомолекулярного соединения, например, воды, спирта, галогенводорода и др. К важнейшим полимерам, получаемым поликонденсацией, относят: сложные полиэфиры, полиамиды, меламино-формальдегидные смолы, мочевино-формальдегидные смолы, фенолформальдегидные, резорцинформальдегидные смолы и др.
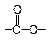
 Сложные полиэфиры содержат повторяющиеся сложноэфирные группы. Получают полиэфиры взаимодействием двухатомных спиртов (этиленгликоль, 1,2-пропандиол) с двухосновными кислотами (адипиновая, малеиновая, терефталевая) по общей схеме:
Сложные полиэфиры содержат повторяющиеся сложноэфирные группы. Получают полиэфиры взаимодействием двухатомных спиртов (этиленгликоль, 1,2-пропандиол) с двухосновными кислотами (адипиновая, малеиновая, терефталевая) по общей схеме:
Сложный полиэфир, полученный поликонденсацией терефталевой кислоты с этиленгликолем, называют полиэтилентерефталатом. Его получают по схеме:

терефталевая кислота этиленгликоль
Полимер используют для формования волокна лавсан, применяемого в производстве верхней одежды, ковров, тюля, фильтровальных тканей и др. Пленки из этого полимера применяются для изготовления лент, которые используются в магнитофонах и в счетно-вычислительных машинах.
Поликонденсацией фосгена с дифенилолпропаном в присутствии основных катализаторов получают сложный полиэфир, называемый поликарбонатом:
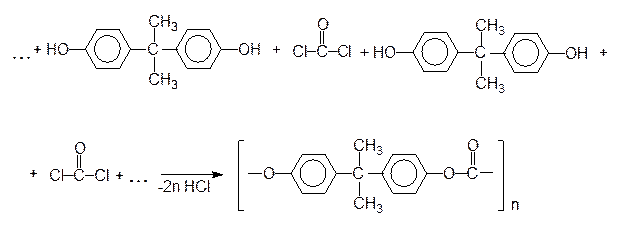
дифенилолпропан фосген
Этот полимер в качестве антикоррозионного и конструкционного материала используется в химической промышленности и машиностроении. Являясь бесцветным и прозрачным как стекло, этот полимер по прочности не уступает стали. Его применяют также для изготовления небьющегося, пуленепробиваемого стекла.
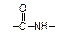 Полиамиды в основной цепи макромолекул содержат амидные связи.
Полиамиды в основной цепи макромолекул содержат амидные связи.
Одним из способов их получения является поликонденсация дикар-боновых кислот с диаминами, например, гексаметилендиамина с адипиновой кислотой по схеме:

Из этого полимера формуют волокно найлон-6,6. Цифры показывают, что исходные диамин и дикарбоновая кислота имеют по шесть атомов углерода. Полиамидные волокна используют для изготовления товаров широкого потребления, кордных нитей для шин, в производстве рыболовных сетей, канатов и др.
К природным высокомолекулярным органическим соединениям, содержащим амидную связь, относятся белки, которые являются основой всего живого и обеспечивают их жизнедеятельность. Белки, независимо от своей функции и видовой принадлежности, построены из 20 аминокислот, соединенных по типу пептидов, т.е. за счет своих аминных и карбоксильных групп. Схематически это можно изобразить так:

амидная
(пептидная)
связь
Аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой аминокислоты. При этом происходит выделение воды и возникает амидная (пептидная) связь. Получившийся продукт, состоящий из остатков двух аминокислот, называется дипептидом. Взаимодействие с другой молекулой аминокислоты образует трипептид, затем тетрапептид и т.д. Таким образом, образуются длинные цепочки из остатков аминокислот, называемые полипептидами. Эти полипептиды и составляют основу молекулы белков. В состав одной молекулы белка может входить несколько сотен и даже тысяч остатков a-аминокислот. Поэтому молекулярная масса белков колеблется в больших пределах – от нескольких тысяч до миллионов.
Белки, встречающиеся в организмах, отличаются друг от друга не только составом аминокислот, но и порядком их сочетания. Из 20 аминокислот может получиться при их комбинации огромное количество различных белковых веществ (» 2×1018). Если учесть, что в белковой молекуле одна и та же аминокислота повторяется много раз и что молекула белка может состоять из нескольких различных полипептидных цепей, то можно утверждать, что число различных белковых молекул почти беспредельно.
При обработке фенола формальдегидом в присутствии кислоты или щелочи образуются соединения с относительно высокой молекулярной массой, в котором фенольные кольца связаны посредством метиленовых звеньев –СH2–. Поликонденсация фенола с формальдегидом – это сложная совокупность последовательных и параллельных реакций. Первоначально фенол реагирует с формальдегидом с образованием о- или п-гидроксиметилфенола, который далее реагирует с другой молекулой фенола с отщеплением воды и образованием соединения, в котором два ароматических кольца соединены метиленовым звеном. Этот процесс продолжается до образования продукта высокой молекулярной массы. Присоединение и конденсация протекают с участием атомов водорода фенольного ядра, находящихся в орто- и пара-положениях по отношению к фенольному гидроксилу.


Продукт поликонденсации фенола с формальдегидом используют для производства радио- и электротехнических деталей с хорошими диэлектрическими свойствами, как конструкционный материал в машиностроении, как синтетический дубитель для получения красителей-дубителей. Феноло-формальдегидные смолы находят применение для производства фанеры и др. материалов на основе древесины, для связывания стекловолокна и асбеста для изготовления звуко- и теплоизоляционных материалов, как основа лаков, эмалей, клеев.
Поликонденсация между меламином и формальдегидом протекает по схеме:
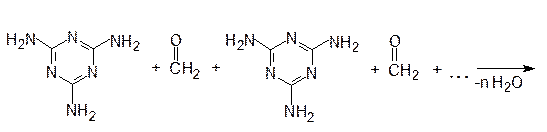 |
меламин формальдегид
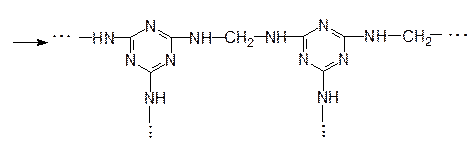 |
Продукт поликонденсации используется для изготовления электротехнических изделий (выключатели, штепсельные розетки), синтетического шпона для отделки мебели и интерьеров, как компонент древесно-стружечных плит, искусственного мрамора и др.
Список литературы
1. Днепровский А.С. и др. Теоретические основы органической химии. Л.: Химия, 1979.
2. Матье Ж. и др. Курс теоретических основ органической химии / Пер. с франц. Б.А. Руденко. М.: Мир, 1975.
3. Терней А. Современная органическая химия / Пер. с англ. Е.И. Карпейской, М.И. Верховцевой. Т.1, 2. М.: Мир, 1981.
4. Робертс Дж. и др. Основы органической химии / Пер. с англ. Ю.Г. Бунделя. М.: Мир, 1968. Ч. 1, 2.
5. Нейланд О.Я. Органическая химия. М.: Высшая школа, 1990.
6. Несмеянов А.Н. и др. Начала органической химии. М.: Химия, 1974. Кн. 1, 2.
7. Энциклопедия полимеров. Т. 1, 2, 3. М.: Советская энциклопедия, 1977.
8. Степаненко Б.Н. Курс органической химии. Т. 1, 2. М.: Высшая школа, 1976.
9. Моррисон Р. и др. Органическая химия / Пер. с англ. В.М.Демьянович, В.А. Смита. М.: Мир, 1974.
10. Сайкс П. Механизмы реакций в органической химии / Пер. с англ. Н.Г. Луценко. М.: Химия, 1991.
11. Агрономов А.Е. Избранные главы органической химии. М.: Химия, 1990.
12. Шретер В. и др. Химия / Пер. с нем. В.А. Молочко, С.В. Крынкиной. М.: Химия, 1989.
13. Березин Б.Д. и др. Курс современной органической химии. М.: Высшая школа, 1999.
14. Шабаров Ю.С. Органическая химия. М.: Химия, 1996, Кн. 1, 2.
15. Артеменко А.И. Органическая химия. М.: Высшая школа, 1998.
16. Днепровский А.С. и др. Теоретические основы органической химии. Л.: Химия, 1991.
17. Реутов О.А. Теоретические основы органической химии. М.: Химия, 1998.
ГАДЕЛЕВА Халима Касимовна
ЗАЙНУЛЛИН Радик Анварович






