В реакцию полимеризации вступают органические соединения с кратной связью, т.е. олефины, диеновые и ацетиленовые углеводороды, альдегиды, нитрилы и др. Полимеризацию этих соединений (мономеров) можно описать следующей общей схемой:
n A=B ® [-A-B-]n
В ходе полимеризации происходит разрыв кратных связей и присоединение молекул мономера друг к другу в определенной последовательности. Основная цепь полимера состоит только из тех атомов, которые были связаны кратной связью.
Под действием катализаторов катионного типа полимеризуются, например, этилен, изобутилен, алифатические альдегиды.
При применении инициаторов анионной полимеризации полимеризуются акрилонитрил, метилметакрилат, изопрен, 1,3-бутадиен.
Радикальная полимеризация используется для промышленного синтеза полиэтилена, поливинилхлорида, полистирола, политетрафторэтилена и др. полимеров.
а) катионная полимеризация
Особенно важное значение получила катионная полимеризация низших олефинов, например, изобутилена, под действием кислот Льюиса. Эти катализаторы (kt) вытягивают пару электронов p-связи. Молекула олефина приобретает при этом положительный заряд на втором олефиновом атоме углерода, который вытягивает пару электронов следующей молекулы олефина, продолжая цепь полимеризации. Цепь растет, пока случайная встреча с анионом не оборвет ее. Схему полимеризации изобутилена можно представить следующим образом:
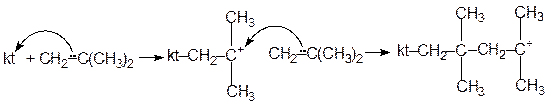
| и т.д. |
Полиизобутилен применяют для электроизоляции, в качестве уплотнительного материала, для приготовления клеев, в производстве водостойких тканей.
б) анионная полимеризация
1,3-Бутадиен в зависимости от природы катализатора и условий полимеризации может полимеризоваться с образованием полимеров 1,2; 1,4-цис и 1,4-транс структур:
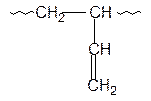
| 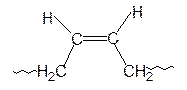
| 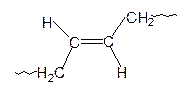
|
| 1,2 | 1,4-цис | 1,4-транс |
Металлоорганические инициаторы типа R-Li вызывают анионную 1,4-полимеризацию, начинающуюся с нуклеофильной атаки алкиланиона R- на диен. Суммарное уравнение анионной 1,4-полимеризации 1,3-бутадиена можно представить как:
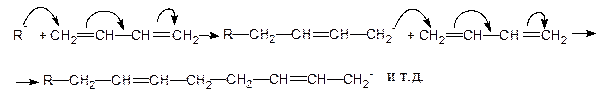
Изопрен (2-метил-1,3-бутадиен) может полимеризоваться в положения 1,2; 1,4-цис; 1,4-транс и 3,4-:
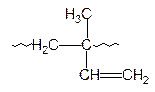
| 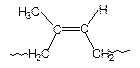
| 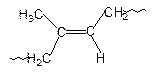
| 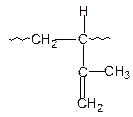
|
| 1,2 | 1,4-цис | 1,4-транс | 3,4 |
Под действием литийорганических соединений, т.е. по анионному механизму, получают 1,4-цис-полиизопрен, который по структуре тождественен с натуральным каучуком. Этот полимер применяют для изготовления практически всех резиновых изделий. 1,4-Транс-полиизопрен, который по структуре аналогичен природному полимеру – гуттаперче, получают, полимеризуя изопрен в присутствии комплексного катализатора TiCl3-Al(C2H5)3 по ионно-координационному механизму. Полимер применяют как изолирующий материал в электро- и радиопромышленности, для изготовления подводных кабелей. Используют его и для изготовления наружного слоя мячей для гольфа.
в) радикальная полимеризация
При полимеризации по радикальному механизму стадия инициирования включает два элементарных акта - образование радикалов (1) и взаимодействие радикала с первой молекулой мономера с образованием нового радикала (2):
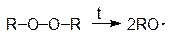
| (1) |
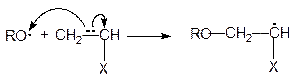
| (2) |
Многократно повторяющиеся акты роста цепи можно описать уравнением:
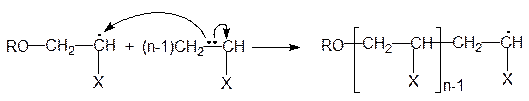
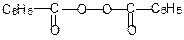 По такому механизму получают в промышленности полиэтилен высокого давления, полимеризуя этилен под действием кислорода или пероксидов (например, бензоила):
По такому механизму получают в промышленности полиэтилен высокого давления, полимеризуя этилен под действием кислорода или пероксидов (например, бензоила):
n CH2=CH2 ® [-CH2-CH2-]n
Полиэтилен занимает первое место в мировом производстве полимеризационных пластиков. Из него получают пористый звуко- и теплоизолирующий материал, предметы домашнего обихода (ведра, корзины, ящики, ванны, бутыли и др.), широко применяют полиэтилен для производства пленок технического и бытового назначения.
Полимеризацией винилхлорида по радикальному механизму получают поливинилхлорид (ПВХ):
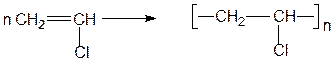
Благодаря высокому содержанию в нем хлора, это негорючий полимер. ПВХ нашел очень широкое применение. Его используют в производстве электроизоляционных материалов, в строительстве для изготовления деталей дверей, окон, покрытий для полов, сантехнического оборудования, искусственной кожи, грампластинок, игрушек, упаковочных материалов, товаров домашнего обихода и т.д.
Продуктом радикальной полимеризации тетрафторэтилена является политетрафторэтилен (тефлон):
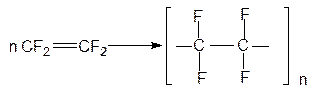
Этот полимер применяют в качестве изоляционного материала в радио- и электротехнике, а также в медицине для изготовления протезов различных органов человека, например, кровеносных сосудов, сердечного клапана и др. Широкое применение находит политетрафторэтилен и как антиадгезионный материал в пищевой промышленности.
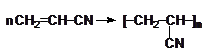 Полиакрилонитрил, получаемый также по радикальному механизму по схеме:, применяют, в основном, для получения полиакрилонитрильных волокон.
Полиакрилонитрил, получаемый также по радикальному механизму по схеме:, применяют, в основном, для получения полиакрилонитрильных волокон.
Полиметилметакрилат, получаемый радикальной полимеризацией метилметакрилата, называют органическим стеклом:
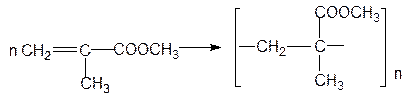
Этот полимер обладает высокой проницаемостью для лучей видимого и УФ-спектра, хорошими физико-механическими свойствами.
Очень активен в реакциях свободнорадикального полиприсоединения стирол. При этом образуется полистирол - пластик, используемый в качестве электроизоляционного материала:
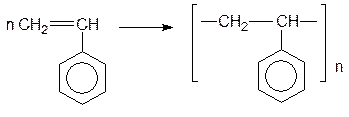
6. РЕАКЦИИ ЗАМЕЩЕНИЯ
6.1. Реакции нуклеофильного замещения
В общем виде реакцию нуклеофильного замещения можно представить следующей схемой:
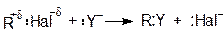
В качестве нуклеофильного реагента (Y) может выступать как анион, так и нейтральная молекула, обладающая неподеленной парой электронов, например: H2O, ROH, H2S, RSH, NH3, OH-, OR-, SH-, Hal-, CN-, NO2-, RCOO- и т.д.
Реакции нуклеофильного замещения - это наиболее важные и типичные реакции алкилгалогенидов, в них происходит обмен атома галогена на различные нуклеофилы:
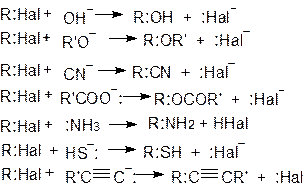
Замещение галогена может осуществляться по двум различным механизмам, а именно, как нуклеофильное бимолекулярное замещение (SN2) и нуклеофильное мономолекулярное замещение (SN1). Термины "бимолекулярное" и "мономолекулярное" обозначают, что в стадиях, определяющих скорость реакций, принимают участие соответственно две и одна молекулы. Символом S (Substitution) обозначают замещение, а N (nucleophilic) - нуклеофильное. SN2-Реакция имеет второй порядок, а SN1 является реакцией первого порядка. В реакциях второго порядка скорость зависит от концентрации двух веществ, а в реакциях первого порядка - от концентрации только одного вещества.
6.1.1. SN2-Реакции
Рассмотрим реакцию бромистого метила с едким натром, приводящую к образованию метилового спирта:
CH3Br + OH- ® CH3OH + Br-
Скорость этой реакции зависит от концентрации обоих исходных соединений, т.е. v = k [CH3Br]×[OH-]. Эта реакция одностадийна и состоит в атаке атома углерода нуклеофилом (ОН-) со стороны наиболее удаленной от брома, образовании новой связи за счет электронов нуклеофила и одновременном разрыве прежней связи углерод-бром:
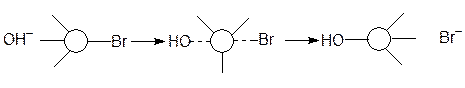
В переходном состоянии группы ОН и Br максимально удалены друг от друга; три атома водорода и атом углерода лежат в одной плоскости, образуя между собой углы в 120 0, т.е. связи углерод-водород расположены как спицы в колесе, а связи углерод-гидроксил и углерод-бром расположены вдоль оси. В результате ОН--группа занимает не то положение, которое занимал раньше бром и образовавшийся спирт имеет конфигурацию, противоположную конфигурации бромида, т.е. реакция протекает с обращением конфигурации. Это явление обращения конфигурации было открыто П. Вальденом в 1896 году и названо "вальденовским обращением".
В реакциях, идущих по SN2 механизму, реакционная способность алкилгалогенидов уменьшается в ряду:
CH3Hal > первичный > вторичный > третичный
Природа нуклеофила также сказывается на скорости реакции замещения, т.к. он участвует в переходной стадии, определяющей скорость.
6.1.2. SN1-Реакции
Рассмотрим взаимодействие трет-бутилбромида с едким натром, в результате которой образуется трет-бутиловый спирт:
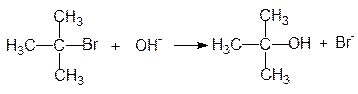
Скорость этой реакции зависит только от концентрации трет-бутилбромида и не зависит от концентрации [OH-]:
v = k [(CH3)3CBr]
Рассматриваемая реакция двухстадийна. На первой, очень медленной стадии, происходит ионизация трет-бутилбромида, а затем быстрая реакция образовавшегося карбониевого иона с нуклеофилом:
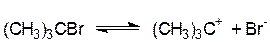
| медленно I стадия | |
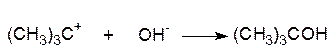
| быстро II стадия | |
Реакционная способность алкилгалогенидов в реакциях первого порядка уменьшается в следующей последовательности:
третичный > вторичный > первичный > CH3Hal
Поскольку на второй стадии SN1-реакции происходит взаимодействие карбкатиона и нуклеофила, то оно будет идти тем быстрее, чем больший заряд локализован на нуклеофиле. Таким образом, скорость реакции будет увеличиваться с ростом основности нуклеофила.
Очевидно, что чем полярнее растворитель, в котором проводят реакцию, тем быстрее происходит ионизация алкилгалогенида и, следовательно, больше скорость реакции, идущей по SN1-механизму.
6.2. Реакции электрофильного замещения в ароматическом ряду
При взаимодействии ароматических соединений с электрофильными реагентами происходит, как правило, отщепление протона ароматического кольца и образование продуктов замещения. Так протекают реакции нитрования, галогенирования, алкилирования, ацилирования, сульфирования, азосочетания и другие. Все перечисленные реакции идут по общей схеме:
ArH + XE ® ArE + H+X-,
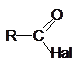 |
где XE = Cl2, Br2, HNO3, H2SO4, RHal,, ArN2+X- и др.
В этих реакциях в качестве электрофильного реагента выступает либо катион, либо сильнополяризованный комплекс, несущий положительный заряд. Например, в реакции нитрования в качестве электрофильного реагента выступает катион нитрония (+NO2), образующийся при растворении азотной кислоты в концентрированной серной кислоте по уравнению:
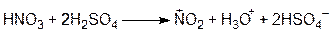
В реакциях азосочетания роль электрофильного реагента играют соли диазония, которые являются продуктами взаимодействия солей первичных ароматических аминов с азотистой кислотой:
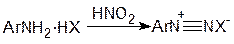
При алкилировании ароматических соединений олефинами в присутствии минеральных кислот электрофильным реагентом служит карбкатион, который образуется по реакции:
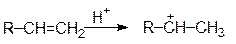
Реакции галогенирования ароматических соединений проводят галогенами в присутствии галогенидов металлов (Al, Fe, Sn и др.). Каталитическое действие галогенидов металлов сводится к поляризации молекулы галогена в результате связывания одного из атомов галогена в прочный анион, причем второй атом галогена получает частично положительный заряд и действует как электрофильный реагент:
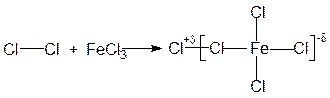
Все реакции электрофильного замещения протекают по одному и тому же механизму. Эти реакции начинаются с атаки электрофильной частицы (Е+) на ароматическую p-электронную систему и образования p-комплекса. В этом комплексе p-электронная система бензола выступает как донор электронов, а электрофильный реагент - как акцептор электронов. Далее p-комплекс быстро диссоциирует с образованием неароматического s-комплекса. В s-комплексе между электрофильной частицей и p-системой имеется s-связь. s-Комплекс - это нестабильный катион, в котором четыре p-электрона рассредоточены на пяти углеродных атомах ядра, тогда как шестой углеродный атом переходит в насыщенное состояние. За этим следует потеря протона и сопутствующая ей реароматизация, так как связывающая водород электронная пара вливается во вновь образующуюся ароматическую шестерку p-электронов. В результате образуется ароматическое соединение, в котором электрофильная частица заместила атом водорода бензольного кольца:
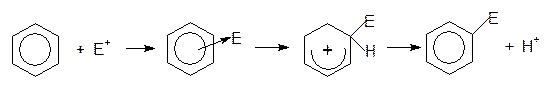
p-комплекс s-комплекс
6.3. Реакции свободнорадикального замещения
 Известно, что алканы по своему химическому поведению являются сравнительно инертными соединениями. Те немногие реакции, в которые они вступают, идут по радикальному механизму с гомолитическим расщеплением связи Эти реакции являются очень важными в практическом отношении. Они позволяют получать галоген-, нитропроизводные, а также алкансульфокислоты и алкансульфохлориды.
Известно, что алканы по своему химическому поведению являются сравнительно инертными соединениями. Те немногие реакции, в которые они вступают, идут по радикальному механизму с гомолитическим расщеплением связи Эти реакции являются очень важными в практическом отношении. Они позволяют получать галоген-, нитропроизводные, а также алкансульфокислоты и алкансульфохлориды.
а) хлорирование алканов
Реакция хлорирования инициируется светом, под действием которого молекула хлора распадается на два радикала (1). Эти радикалы, обладая высокой реакционной способностью, могут разорвать гомолитически связь С-Н, которая сама по себе очень устойчива. В этой стадии (2) происходит образование хлористого водорода и алкильного радикала. В свою очередь, алкильный радикал атакует молекулу хлора и образует хлористый алкил и радикал хлора (3):
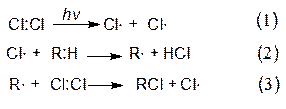
Вновь образовавшийся радикал хлора может атаковать как молекулу алкана, так и молекулу образовавшегося хлористого алкила, замещая в последнем второй атом водорода.
Таким образом, при хлорировании метана, в ходе последовательного замещения атомов водорода, образуются моно-, ди-, три- и тетрахлорметаны:
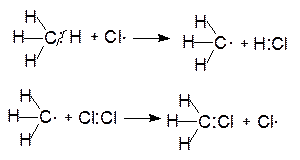
хлористый метил
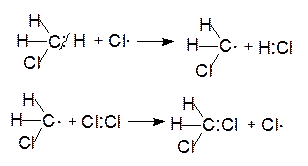
хлористый метилен
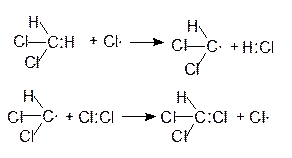
хлороформ
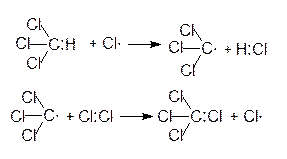
четыреххлористый углерод
Как видно из приведенных схем, радикалы хлора постоянно регенерируются, т.е. первоначальный радикал хлора дает начало целой цепи последовательных реакций. Такие радикальные процессы называются цепными.
Реакция может прекратиться в тех случаях, когда радикалы хлора рекомбинируют (4) или соединяются с алкильными радикалами (5), или теряют энергию в результате столкновения со стенками реакционного сосуда. Эти реакции называют "обрывом" цепи:
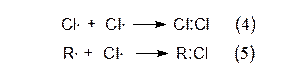
Установлено, что при фотохимическом хлорировании более сложных алканов, легче всего замещаются атомы водорода при третичном атоме углерода, труднее всего при первичном.
По приведенному механизму происходит замещение атомов водорода в алифатических цепочках гомологов бензола. Например, при хлорировании толуола в боковую цепь последовательно образуются хлористый бензил, хлористый бензилиден и бензотрихлорид по уравнению:
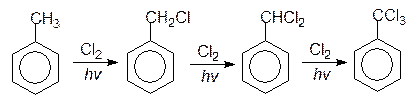
| толуол | хлористый бензил | хлористый бензилиден | бензотрихлорид |
б) нитрование алканов
По свободнорадикальному механизму протекает также реакция нитрования алканов разбавленной азотной кислотой. Эту реакцию называют реакцией Коновалова: RH + HNO3 ® RNO2 (нитроалкан). Свободные радикалы (·NO2) образуются при нагревании реакционной смеси до 110-140 0С. Как и в случае галогенирования алканов, их строение играет существенную роль при нитровании. Легче замещается атом водорода у третичного атома углерода и труднее всего - у первичного атома углерода.
в) превращение алканов в хлорангидриды сульфокислот
При взаимодействии алканов с сернистым ангидридом и хлором при освещении происходит замещение атома водорода на хлорсульфонильную группу (-SO2Cl):
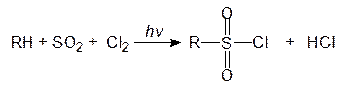
алкансульфохлорид
Стадии этой реакции:
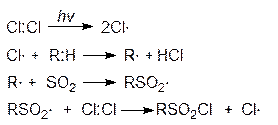
Алкансульфохлориды легко гидролизуются до алкансульфокислот (RSO2OH), натриевые соли которых (RSO3-Na+ - алкансульфонат натрия) проявляют свойства, подобные мылам, и применяются в качестве детергентов.
7. Реакции элиминирования
Реакции элиминирования – это реакции отщепления атомов или групп атомов от органической молекулы, сопровождающиеся образованием кратной связи. Реакции этого типа обозначают символом Е (elimination – отщепление). В подавляющем большинстве случаев атомы или группы атомов отщепляются от соседних углеродных атомов. Эти реакции рассматриваются как 1,2- или a, b-элиминирование:
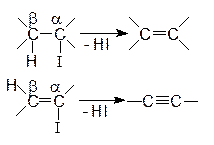 |
Существует несколько разновидностей реакций элиминирования:
1) дегидрирование, заключающееся в отщеплении водорода путем окисления или нагревания (пиролитическое дегидрирование);
2) дегидратация – это отщепление воды.
Дегидратацию проводят различными способами. Например, нагревая спирт с серной или фосфорной кислотой при температуре около 200 °С или пропуская пары спирта над оксидом алюминия при 350-400 °С:
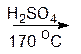 |
CH3CH2OH CH2=CH2
этанол этилен
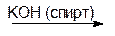 3) дегидрогалогенирование – отщепление галогенводородов путем действия гидроксидов металлов на моно- и дигалогеналканы:
3) дегидрогалогенирование – отщепление галогенводородов путем действия гидроксидов металлов на моно- и дигалогеналканы:
CH3-CH2-CH2-Cl CH3-CH=CH2
н-пропилхлорид пропилен
Наиболее важной группой реакций элиминирования являются те, в которых атом водорода отщепляется в виде протона от b-углеродного атома. Однако известны реакции, когда происходит отщепление других атомов или групп от b-углеродного атома. Например, это реакции 1,2-дебромирования, инициируемые некоторыми металлами (Zn), ионами металлов (Fe+2):
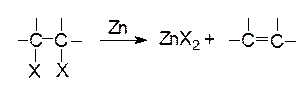 |
Реакции отщепления обратны реакциям присоединения и тоже могут протекать как радикальные, электрофильные и нуклеофильные реакции, обозначаются соответственно как ER, EE, EN.
Реакции электрофильного отщепления (ЕЕ) происходят под действием электрофильного реагента. В практике для синтеза органических соединений реакции подобного типа имеют ограниченное применение и поэтому в данном методическом пособии не рассматриваются.
Примером реакций радикального отщепления (ER) может служить крекинг высших алканов, при котором происходит гомолитический разрыв связи С-С и образование радикалов:
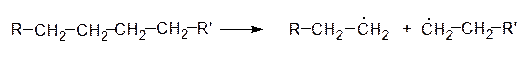 |
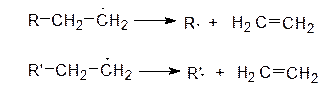 Образующиеся свободные радикалы самопроизвольно распадаются, образуя молекулы алкенов и новые радикалы:
Образующиеся свободные радикалы самопроизвольно распадаются, образуя молекулы алкенов и новые радикалы:
В большинстве реакций элиминирования одной из отщепляющихся частиц является протон, а другой – нуклеофил. Наиболее известными примерами реакций нуклеофильного элиминирования (EN) служат широко применяемые в синтезе алкенов реакции дегидрогалогенирования, заключающиеся в отщеплении галогенводорода от алкилгалогенидов, особенно от алкилбромидов в присутствии оснований (1), а также катализируемая кислотой дегидратация спиртов (2):
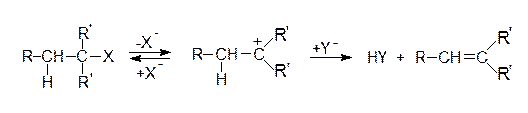 |
(1)
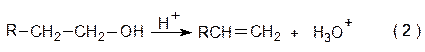 |
В реакциях нуклеофильного отщепления нуклеофильный реагент взаимодействует с атомом водорода, находящимся в a-положении к положительно заряженному атому углерода и отщепляет его в виде протона. Реакция может протекать как двухстадийный процесс или одностадийный. В соответствии с этим различают механизмы EN1 и EN2. Эти механизмы отличаются друг от друга последовательностью расщепления связей Н-С и С-Х.
7.1. Реакции мономолекулярного отщепления (EN1)
Рассмотренная выше реакция (1) протекает по двухстадийному механизму. На первой (медленной) стадии происходит диссоциация исходного соединения по связи С-Х и образование карбкатиона. На второй (быстрой) стадии образовавшийся карбкатион взаимодействует с нуклеофилом, который отрывает протон у углеродного атома, находящегося в a-положении к катионному центру. Определяющей скорость всей реакции является, очевидно, самая медленная стадия, в которой участвует одна молекула и происходит диссоциация соединения по связи С-Х. Поэтому скорость реакции определяется только концентрацией алкилгалогенида, т.е. кинетическое уравнение реакции имеет вид:
W = K× [CRX]
Факторами, влияющими на протекание реакции мономолекулярного отщепления, являются:
1). Структура алкильного радикала алкилгалогенида. При ионизации исходного алкилгалогенида должен, очевидно, образовываться относительно наиболее устойчивый карбкатион. Учитывая тот факт, что устойчивость карбкатионов в ряду: третичный > вторичный > первичный падает, то и элиминирование в указанном ряду алкилгалогенидов замедляется. Первичные алкилгалогениды практически не подвергаются EN1 элиминированию.
2). Природа растворителя. Скорость реакции EN1 элиминирования тем выше, чем полярнее растворитель, в котором ведут реакцию.
Если в ходе реакции элиминирования возможно образование более одного алкена в результате отщепления различных протонов от карбкатиона, то согласно правилу Зайцева, предпочтительнее идет образование более замещенного, т.е. термодинамически наиболее устойчивого алкена. В приведенном ниже примере, в соответствии с элиминированием по Зайцеву, образование алкена (а) более предпочтительно, чем алкена (б):
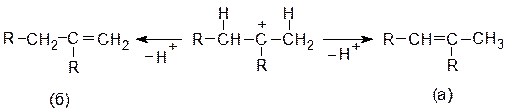 |
7.2. Реакции бимолекулярного отщепления (EN2)
В этих реакциях связи С-Х и С-Н разрываются одновременно в согласованном одноступенчатом процессе. Реакции протекают по схеме:
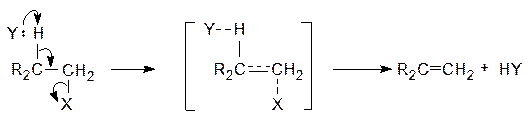 |
В стадии, определяющей скорость реакции, участвуют две молекулы, а кинетическое уравнение имеет вид: W = K×[CRX]×[Y], т.е. EN2-реакции имеют второй кинетический порядок.
Исследования показали, что в большинстве случаев происходит анти-элиминирование Н и Х, т.е. они отщепляются, как это видно из приведенной выше схемы, с «противоположных сторон».
Алкилгалогениды, в которых возможно отщепление различных b-протонов, могут привести к образованию более одного алкена:
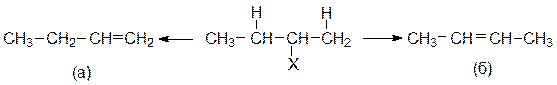 |
Наиболее вероятный ход реакции элиминирования – это ее протекание в соответствии с правилом Зайцева: преобладающим будет образование того алкена, который имеет наибольшее число алкильных заместителей у атомов углерода, образующих двойную связь, т.е. продукта (б) в вышеприведенной схеме.
Реакционная способность алкилгалогенидов в реакциях бимолекулярного элиминирования изменяется в той же последовательности, что и в реакциях мономолекулярного элиминирования, т.е. падает в ряду: третичный > вторичный > первичный. Этот ряд отражает относительную устойчивость образующихся в ходе реакции алкенов.
Одним из факторов, влияющим на скорость реакции EN2, является сила используемого основания Y: с увеличением силы основания скорость реакции растет.






