
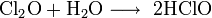
Хлорная кислота НС1О4 самая устойчивая из всех кислородных кислот
хлора, с сильно выраженными кислотными свойствами (является самой
сильной кислотой из всех известных кислот). Хлорная кислота представля-
ет собой дымящую на воздухе жидкость. Она разъедает кожу и вызывает на
ней опасные раны. При нагревании выше 90
С и при соприкосновении с
органическим веществами (бумагой, деревом) НС1О4 разлагается с взры-
вом, а иногда разлагается с взрывом даже при стоянии в темноте:
4 НС1О4 = 4С1О2↑ + 3 О2↑ + 2Н2O
В водных растворах она вполне устойчива. В разбавленных растворах
НС1О4 и ее соли перхлораты не проявляют окислительных свойств. Без-
водная хлорная кислота и ее сухие соли – сильные окислители.
Хлорную кислоту получают отгонкой при пониженном давлении из сме-
си перхлората с концентрированной серной кислотой:
КС1О4 + H2SO4 (конц.) = КНSO4 + НС1О4
При охлаждении водных растворов выделяется в виде кристаллогидратов –
Н3О+С1О4-
При обезвоживании хлорной кислоты получают оксид хлора(VII):
2 НС1О4 + Р2О5 = С12О7 + 2 НРО3
Оксид хлора(VII) С12О7 при обычных условиях – маслянистая бесцвет-
ная жидкостьПри нагревании выше 120
С разлагается с взрывом.
Хлорную кислоту и ее соли получают электролизом хлоратов или хло-
ритов с платиновым анодом:
КС1О3 + Н2О электролиз КС1О4 + Н2
Наиболее устойчивые кислородные соединения хлора – это соли хлорной
кислоты. Большинство перхлоратов хорошо растворяются в воде. Их полу-
чают действием НС1О4 на основания или карбонаты металлов. КС1О4 по-
лучают нагреванием хлората калия без катализатора:
4 КС1О3 → 3 КС1О4 + КС1
В ряду НС1О– НС1О2 – НС1О3 – НС1О4 с увеличением степени окисле-
ния хлора полярность связи Н – О увеличивается, из-за оттягивания элек-
тронной плотности от связи Н – О на связь С1 – О, а сила кислот при этом
возрастает. В этом же ряду при переходе от С1О к С1О4
устойчивостьанионов возрастает, так как увеличивается число электронов, принимающих участие в образовании связей С1– О (σ- и π-связей). Порядок связи хлор – кислород возрастает от 1 до 1,5. Возрастает и энергия связи хлор – кислород от 209 до 363,5 кДж/моль. В связи с этим в данном ряду кислот их окислительная активность уменьшается. Гипохлориты проявляют окислительные свойства в любой среде (нейтральной, кислой и щелочной), хлораты – только в сильнокислой среде, а перхлораты практически не проявляют окислительных свойств в растворах:
КС1О4 + КI + H2SO4 ≠
КС1О3 + 6 КI + 3 H2SO4 = КС1 + 3 К2SO4 + 3 I2 + 3 Н2О
КС1О3 + 6 КI + Н2О ≠
КС1О + 2 КI + Н2О = КС1 + I2 + КOН28
Хлорноватая кислота — HClO3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается:
8HClO3 = 4HClO4 + 3O2 + 2Cl2 + 2H2O






