ЛЕКЦИЯ 5
Изменение потенциала электрода при прохождении тока называется поляризацией:
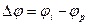 ,
,
где  - поляризация;
- поляризация;  - потенциал электрода при прохождении тока;
- потенциал электрода при прохождении тока;  - равновесный потенциал.
- равновесный потенциал.
Термин «поляризация» обозначает и само физическое явление, и величину поляризации. Различают катодную 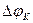 и анодную
и анодную  поляризации. Для исследования поляризации строят экспериментальную кривую зависимости потенциала электрода от силы протекающего через электрод тока.
поляризации. Для исследования поляризации строят экспериментальную кривую зависимости потенциала электрода от силы протекающего через электрод тока.
Чтобы понять сущность измерения поляризации рассмотрим элемент Даниэля-Якоби с включенным во внешнюю цепь переменным сопротивлением R, вольтметром V, амперметром А (рис.1).
Рис.1 Поляризующийся медно-цинковый элемент
Разность потенциалов между цинковым и медным электродами в отсутствии тока близка к 1 В. Если, изменяя внешнее сопротивление, добиться протекания тока во внешней цепи, то напряжение элемента становится меньше 1 В вследствие поляризации обоих электродов. Чем больше ток во внешней цепи, тем меньше напряжение; при коротком замыкании напряжение между медным и цинковым электродами приближается к нулю. Влияние силы тока на напряжение элемента Даниэля- Якоби можно графически изобразить в виде поляризационной диаграммы (рис.2), которая представляет собой зависимость потенциалов 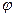 медного и цинкового электродов от полного тока I. Символы
медного и цинкового электродов от полного тока I. Символы 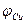 и
и 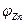 отвечают разомкнутому элементу.
отвечают разомкнутому элементу.
Рис.2. Поляризационная диаграмма медно-цинкового элемента
Поляризации цинкового электрода соответствует линия abc, поляризации медного электрода линия def. При силе тока, равной  , поляризация цинка равна
, поляризация цинка равна 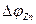 , а меди -
, а меди - 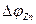 . Разность потенциалов поляризованных электродов равна силе тока
. Разность потенциалов поляризованных электродов равна силе тока  , умноженной на общее сопротивление, которое складывается из сопротивления металлов
, умноженной на общее сопротивление, которое складывается из сопротивления металлов 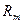 , сопротивления электролита
, сопротивления электролита  :
:
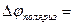
 (
( +
+  ).
).
При короткозамкнутом элементе ток максимален, а сопротивлением металлов можно пренебречь, в этом случае разность потенциалов снижается до минимума и равна:
 .
.
Различают три вида поляризаций: концентрационная поляризация, активационная поляризация и омическое падение напряжения.
Концентрационная поляризация – изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока.
Рассмотрим медный электрод в элементе Даниэля-Якоби.
В отсутствие внешнего тока потенциал меди  (1) можно определить по формуле Нернста:
(1) можно определить по формуле Нернста:
 (1) =0,34+
(1) =0,34+ 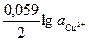 ,
,
где 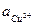 - активность ионов меди.
- активность ионов меди.
Если в элементе течет ток, то медь осаждается на электроде, при этом концентрация около поверхности, а следовательно, активность ионов меди снижается до (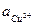 )
)  тогда потенциал медного электрода равен:
тогда потенциал медного электрода равен:
 (2) =0,34+
(2) =0,34+  .
.
Вследствие того, что (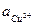 )
) 
 , потенциал поляризованного катода более отрицателен. Разность потенциалов
, потенциал поляризованного катода более отрицателен. Разность потенциалов  (2) и
(2) и  (1) и есть концентрационная поляризация:
(1) и есть концентрационная поляризация:
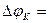
 (2) –(1)
(2) –(1)  = -
= - 
Чем больше ток, протекающий в системе, тем меньше концентрация ионов меди около электрода (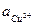 )
)  , а значит, больше концентрационная поляризация. Плотность тока, при которой (
, а значит, больше концентрационная поляризация. Плотность тока, при которой (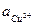 )
)  приближается к нулю называется предельной плотностью тока.
приближается к нулю называется предельной плотностью тока.
Концентрационная поляризация связана с предельной плотностью тока выражением:
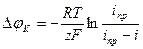
где 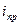 - предельная плотность тока для катодной реакции, A/
- предельная плотность тока для катодной реакции, A/  ;
; 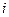 - плотность внешнего тока, A/
- плотность внешнего тока, A/  .
.
Активационная поляризация  обусловлена замедленность электродной реакции, потребностью в дополнительной энергии для протекания электродной реакции. Примером может служить восстановлении ионов водорода на катоде:
обусловлена замедленность электродной реакции, потребностью в дополнительной энергии для протекания электродной реакции. Примером может служить восстановлении ионов водорода на катоде:

Активационная поляризация этого процесса называется водородным перенапряжением.
На платиновом катоде процесс восстановления водорода идет в такой последовательности: в начале идет относительно быстрая реакция:

где  - атомы водорода, адсорбированного на поверхности металла.
- атомы водорода, адсорбированного на поверхности металла.
Затем из атомов водорода образуются молекулы 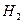 и пузырьки газообразного водорода:
и пузырьки газообразного водорода:

.
Эта реакция протекает достаточно медленно и ее скорость, как скорость самой медленной стадии, определяет значение водородного перенапряжения на платине.
Активационная поляризация  любого типа возрастает с увеличением плотности тока
любого типа возрастает с увеличением плотности тока 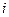 согласно уравнению Тафеля:
согласно уравнению Тафеля:

где  и
и 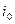 - константы для данного металла и среды электролита, зависящие от температуры. Знак «+» относится к анодному перенапряжению, знак «-» - к катодному перенапряжению.
- константы для данного металла и среды электролита, зависящие от температуры. Знак «+» относится к анодному перенапряжению, знак «-» - к катодному перенапряжению.
В таблице даны значения водородного перенапряжения для различных металлов при разных условиях.
Таблица 1






