Назначение и основные типы щелочных аккумуляторов
Щелочные аккумуляторы – это аккумуляторы, в которых электролитом служит водный раствор щелочи. Они широко применяются для питания аппаратуры связи и других потребителей постоянного тока.
Существует несколько типов щелочных аккумуляторов, отличающихся вешним видом, конструкцией сосудов, электродов и другими признаками. Они разделяются:
· По составу активной массы:
- никель-кадмиевые (НК),
- никель-железные (НЖ),
- серебряно-цинковые (СЦ)
Щелочные никель-кадмиевые (НК) аккумуляторы по сравнению с другими источниками энергии обладают рядом преимуществ: высокий КПД (отдача по емкости), простота эксплуатации и хранения, работоспособность в широком диапазоне температур, конструктивная прочность, высокая надежность, небольшой саморазряд, большой срок службы.
Щелочные никель-железные (НЖ) аккумуляторы используются в тех областях, где такие их недостатки, как узкий температурный интервал работоспособности, значительный саморазряд и несколько более сложное эксплуатационное обслуживание, не имеют существенного значения.
Щелочные серебряно-цинковые (СЦ) аккумуляторы обладают при небольших габаритах и массе большей емкостью, малым внутренним сопротивлением, большим по сравнению с НК аккумуляторами напряжением разряда (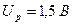 ), имеют высокую стоимость, малый срок службы, худшие эксплуатационные возможности при низких температурах.
), имеют высокую стоимость, малый срок службы, худшие эксплуатационные возможности при низких температурах.
Для питания аппаратуры связи получили наибольшее распространение никель-кадмиевые аккумуляторы.
· По конструкции пластин (электродов):
- ламельные
- безламельные.
· По способу исполнения:
- открытого исполнения с вентильными пробками
- герметичные.
· По конструкции корпуса:
- призматические
- цилиндрические
- дисковые.
Принцип действия и общее устройство
химических источников тока.
Конструктивное выполнение химических источников тока может быть самым различным, но во все первичные и вторичные ХИТ входят:
Положительные электроды, выполняемы из меди, двуокиси свинца, гидрата закиси никеля, серебра и других активных веществ.
Отрицательные электроды, выполняемые из цинка, губчатого свинца, окиси кадмия, окиси железа, цинка и других активных веществ.
Электролит, которым служат водные растворы кислот, щелочей, солей.
Сосуд, изготовляемый из стали, пластмассы, стекла.
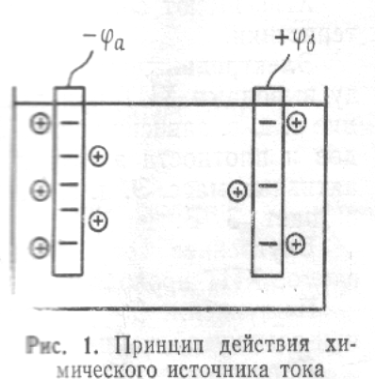
Разность потенциалов в ХИТ образуется вследствие ого, что при погружении металлического электрода в раствор электролита под влиянием сил электролитической упругости происходит растворение металла. При переходе в раствор каждый атом метала теряет некоторое количество электронов, расположенных на его внешней орбите, образуя положительный ион, который переходит в электролит и располагается вблизи поверхности электродов на границе электрод-электролит.
В связи с тем, что электроны атомов, вышедших из металла, остались в электроде, а электролит пополнился положительными ионами металл, электрод приобретает отрицательный заряд, а прилегающий к электроду слой электролита – положительный.
Разность потенциалов между электролитом и электродом называется электродным потенциалом.
При погружении в электролит разнородные металлы будут отдавать в раствор разное количество ионов в зависимости от активности металла; это приведет к Ому, что каждый из металлов-электродов будет обладать различным электродным потенциалом.
В результате разности потенциалов между электродами создается э.д.с. химического источника 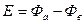 , где
, где 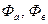 - электродные потенциалы.
- электродные потенциалы.
При замыкании электродов проводником на одном из них происходит процесс окисления (отдача электронов), а на втором – восстановления (получения электронов). Первый электрод считается отрицательным, а второй – положительным.






