Лабораторная работа №6.
Равновесие процесса диссоциации слабой одноосновной кислоты HX в полярном растворителе (например, Н2О):
НХ ↔ Н+ + Х- (1)
может быть охарактеризовано истинной или термодинамической константой диссоциации:
Ка =  (2)
(2)
где аН+, аХ-, аНХ – равновесные активности участников реакции этого процесса. Константа Ка является основной характеристикой кислоты, определяющей ее силу в дано растворителе, а ее численное значение зависит от природы кислоты, растворителя и температуры, но не зависит от состава раствора.
Активности в (2) можно связать с равновесными молярными концентрациями [H+ ], [Х- ], [HХ] и соответствующими коэффициентами активности «у» участников процесса (1):
аН+ = [H+ ] ∙ ун+
ах- = [Х- ] ∙ ух- (3)
анх = [HХ ] ∙ унх
Подставляя (3) в (2),получаем:
Кв = 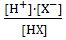 ∙
∙ 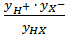 = Кс ∙ Ку (4)
= Кс ∙ Ку (4)
где первый множитель Кс называется концентрационной константой диссоциации.
Сомножитель Ку в (4) отражает отклонение системы от идеальности, связанное в растворах электролитов с межионным взаимодействием, а оно, в свою очередь меняется, при изменении состава раствора и потом величина Ку будет разной в растворах с разной концентрацией кислоты. Последнее обстоятельство делает зависящей от состава раствора и концентрационную константу диссоциации.
Кс = 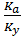 (5)
(5)
В двух случаях Кс приобретает то же свойство, которым обладает термодинамическая константа Ка - независимость от концентрации кислоты:
а) в разбавленных растворах кислоты при Cк→ 0 величины уi ≈ 1, тогда Ку → 1 и Кс ≈ Ка;
б) в растворах с одинаковой и малой ионной силой I = 
 const величины
const величины
уi = const (правило Льюиса-Рендалла, 1921 г.), тогда
Ку = const и Кс = 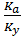 = const.
= const.
В лабораторной практике условие постоянства ионной силы при изучении равновесий диссоциации и комплексообразования часто достигается путем введения в раствор избытка индифферентного электролита (например, NaCl, KC1 и др.), на фоне которого смещение равновесия в изучаемом процессе практически не изменяет ионную силу раствора. В этом случае величина Кс будет зависеть как от природы фонового электролита, так и от его концентрации в растворе - эту информацию обязательно нужно указывать при записи результатов эксперимента по расчету Кс.
Для реакций, протекающих в растворах, концентрационную константу равновесия, как правило, находят путем определения состава равновесной реакционной смеси, причем анализ раствора желательно проводить физико-химическими методами, когда измеряемое свойство однозначно связано с его составом и нет необходимости введения в систему новых реагентов, способных изменять положение равновесия. Наиболее широкое применение нашли потенциометрия, спектрофотометрия и другие методы.
В качестве примера рассмотрим потенциометрическое определение Кс слабой кар-боновой кислоты НХ (уксусная, пропионовая и др.) с использованием метода Бьеррума. Аналогичную методику можно использовать для определения ступенчатых констант диссоциации слабых многоосновных кислот (фосфорная, угольная и др.).
1) Готовят растворы соли NaX и соляной кислоты с концентрациями C0 (NaX) и C0 (НС1) (обычно = 0.01 М), где в качестве растворителя используют раствор индифферентного фонового электролита, например, NaCl, KC1 и др., с концентрацией 1-3 М. Важно, что при смешении растворов NaX и НСl концентрация фона не меняется.
2) На каждом шаге титрования аликвоты V0 раствора NaX раствором НСl устанавливается равновесие:
NaX → Na+ + X-
Х- + Н+ НХ
Введем константу равновесия этого процесса - константу ассоциации:
β= 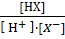 , причем Kc=
, причем Kc=  (6)
(6)
3) В методе Бьеррума используют вспомогательную функцию образования n
ассоциата НХ:
n = 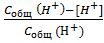 , (7)
, (7)
где Собщ.(Н+) = С(НС1) - общая концентрация введенных в раствор ионов Н+, равная кон-
центрации соляной кислоты; Собщ.(Х- ) = С(NaX) - общая концентрация ионов X- в растворе,
равная концентрации NaX; [H+]- равновесная концентрация свободных ионов водорода.
Первые две концентрации рассчитывают на каждом шаге титрования по формулам:
Собщ.,i (H+ ) = Ci(HCl) =  (8)
(8)
Собщ.,i (X- ) = Ci(NaX)= 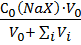 (9) (9)
(9) (9)
где Vi - добавка раствора кислоты на i -ом шаге титрования.
Концентрацию [Н+] определяют потенциометрически на основе калибровочного графика зависимости ЭДС стандартной ячейки для измерения рН раствора от (-lg Ci (H+))
4) Введенные в раствор ионы Н+ существуют в нем в двух формах - свободной Н+ и связанной в виде НХ:
Cоб щ (H+) = [Н+ ] + [НХ] = [Н+ ] + β ∙ [Н+ ][Х- ].
Ион X- также существует в растворе в двух формах - свободной X- и связанной в виде НХ:
Cобщ (Х- ) = [X- ] + [HX] = [X- ] + β ∙ [H+ ] ∙ [X- ] = [X-] ∙ (l + β ∙ [H+]).
Подставляя найденные выражения в n, получаем:
n = 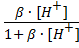 или
или  = 1+
= 1+ 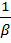 ∙
∙ 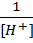 = 1 + Kc ∙
= 1 + Kc ∙ 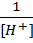 (10)
(10)
Последнее соотношение есть уравнение прямой в координатах  от
от  , причем пря-
, причем пря-
мая пересекает ось ординат в единице, а тангенс угла наклона tgα = 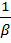 = Кc
= Кc
При определении ступенчатых констант диссоциации слабых многоосновных кислот используют растворы соответствующих кислых солей. Например, титрование растворов NaH2P04 и Na2HP04 соляной кислотой позволяет определить первую и вторую константы диссоциации фосфорной кислоты, а титрование раствора NаНСОз - первую константу диссоциации угольной кислоты.
Аналогичным образом можно определить константу гидролиза органических аминов:
R-NH2 + Н20 R-NН3+ + ОН- (11)
Kc =  (12)
(12)
Если учесть [ОН-] = 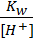
то
Kc =  или
или 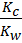 =
= 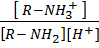 = β (13)
= β (13)
Константа βхарактеризует равновесие:
R-NH2 + Н+ R-NН3+ (14)
и для ее нахождения вводят вспомогательную функцию образования:
n = 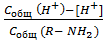 , (15)
, (15)
По результатам титрования раствора R-NH2 раствором НСl на каждом шаге рассчитывают функцию п и строят график в координатах 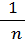 от
от  , из которого находят:
, из которого находят:
tgα = 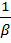 =
=  и Кс =
и Кс =  (16)
(16)
Цель работы: определить концентрационную константу диссоциации слабой кислоты или константу гидролиза амина методом потенциометрического титрования при заданной концентрации фонового электролита.






